第三节 配合物的稳定性
一、配离子的离解平衡
将氨水加到硝酸银溶液中,则有[Ag(NH3)2]+配离子生成,反应式为:
Ag[SB]+[/SB]+2NH[XB]3[/XB]→[Ag(NH[XB]3[/XB])[XB]2[/XB]][SB]+[/SB]
此反应称为配合反应(也叫络合反应)。
由于配离子是由中心离子和配位体以配价键结合起来的,因此,在水溶液中比较稳定。但也并不是完全不能离解成简单离子,实质上和弱电解质类似,也有微弱的离解现象。
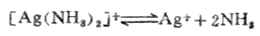
(一)配合物的稳定常数
配合物的稳定性,可以用生成配合物的平衡常数来表示,例如:
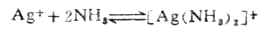
应用化学平衡原理,可得:
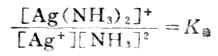
K稳值越大,表示形成配离子的倾向越大,此配合物越稳定。所以配离子的生成常数又称为稳定常数(附录八)。
(二)分布稳定常数
配合物在溶液中的生成与离解,与多元酸、碱相似,也是分级进行的,而且各级离解或生成常数也不一样。例如,Cu2+与NH3逐步配合过程中的分步稳定常数(30℃)分别为:
K1,K2,K3,K4称为逐级稳定常数。由上可见,配合物的逐级稳定常数随着配位数的增加而下降。一般认为,随着配位体数目增多,配位体之间的排斥作用加大,故其稳定性下降。
配合物的逐级稳定常数和稳定常数间有下述关系:
K= K1·K2·K3·K4…Kh
对[Cu(NH3)4]2+来说,其稳定性k 为:
K= K1·K2·K3·K4
K=(1.41×104)(3.17×103)(7.76×102)(1.39×102)=4.8×1012
(三)不稳定常数
在水溶液中,[Ag(NH.3)2]+是稳定的,不过像其他弱电解质一样也有少数[Ag(NH.3)2]+发生离解,可用下式表示:

则平衡常数表达式为:
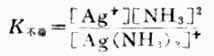
K不稳值愈大,表示配离子离解愈多,故称K不稳为配离子的不稳定常数。
K稳和K不稳互成倒数:

二、配合平衡的移动
金属离子Mn+和配位体A-生成配离子MA(n-x)+x,在水溶液中存在如下平衡:

根据平衡移动原理,改变Mn+或A-的浓度,会使上述平衡发生移动。若在上述溶液中加入某种试剂使Mn+生成难溶化合物,或者改变Mn+的氧化状态,都会使平衡向左移动。若改变溶液的酸度使A-生成难离解的弱酸,也可使平衡向左移动。
配合平衡同样是一种相对的平衡状态,它同溶液的PH值、沉淀反应、氧化还原反应等都有密切的关系。
(一)与酸度的关系
根据酸碱质子理论,所有的配位体都可以看作是一种碱。因此,在增加溶液中的H+浓度时,由于配位体同H+结合成弱酸面使配合平衡向右移动,配离子平衡遭到破坏,这种现象称为酸效应,例如:
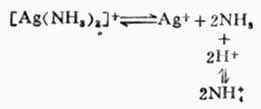
配位体的碱性愈强,溶液的PH值愈小,配离子愈易被破坏。
金属离子在水中,都会有不同程度的水解作用。溶液的PH值愈大,愈有利于水解的进行。例如:Fe3+在碱性介质中容易发生水解反应,溶液的碱性愈强,水解愈彻底(生成Fe(OH)3沉淀)。
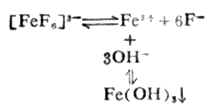
因此,在碱性介质中,由于Fe3+水解成难溶的Fe(OH)3沉淀而使平衡向右移动,因而[FeF6]3-遭到破坏,这种现象称为金属离子的水解效应。
(二)与沉淀反应的关系
当向含有氯化银沉淀的溶液中加入氨水时,沉淀即溶解。

当在上述溶液中加入溴化钠溶液时,又有淡黄色的沉淀生成。
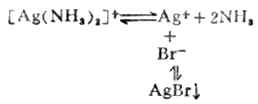
由于AgBr的溶解度比AgCL的溶解度小得多,因而Br-=争夺Ag+的能力比CL-的大,所以能产生AgBr沉淀而不能产生AgCL沉淀。沉淀剂与金属离子生成沉淀的溶解度愈小,愈能使配离子破坏而生成沉淀。
(三)与氧化还原反应的关系
配合反应的发生可以改变金属离子的氧化能力。例如:当PbO2(Pt+)与盐酸反应时,其产物不是PbCL4,而是PbCL2和CL2。但是当它形成[PbCL6]2-配离子后,Pb就能保持它的+4氧化态。
配合反应影响氧化还原反应的方向。例如,Fe3+可以把I-氧化成I2:
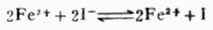
在加入F-后,由于生成[FeF6]3-,减少了Fe3+的浓度,使平衡向左移动。
当我们考查配合反应对氧化还原反应的影响时,不仅要注意配离子的形成,而且还要注意配离子的稳定性。
