第一节 烷烃
一、烷烃的构造
烷烃的构造特点是其中的碳原子与碳原子都以单键相结合,其余价键都和氢原子相连接,含有一个、两个和三个碳原子的烷烃构造如下;
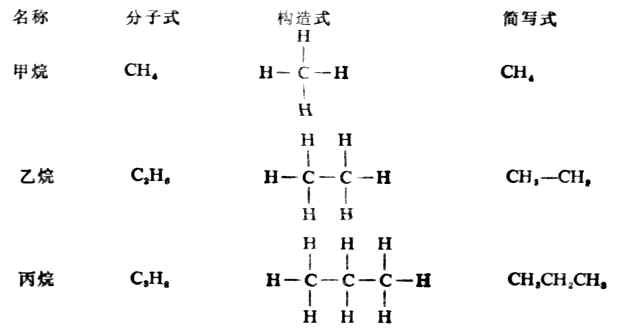
其它烷烃的构造与乙烷、丙烷相似。除甲烷外,烷烃分子中的各个碳原子上所连的四个原子或原子团不尽相同,所以其键角稍有变化,但仍接近于109°28′,因为这样的空间排布,能量最低,体系最稳定。这些分子中碳原子与碳原子连结成链状,其分子的形状是一系列共享一个顶点的四面体。如乙烷(图11-1)
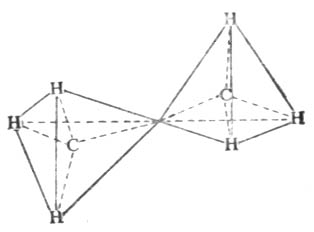
图11-1 乙烷的链状结构
二、烷烃的同系列和通式
根据烷烃的构造特点和它的原子组成可知,最简单的烷烃是含有一个碳原子的甲烷CH4,其次是含有两个碳的乙烷C2H6。按烷烃分子中碳与氢原子数可排列如表11-1。
表11-1 烷烃的同系列
| 碳原子数 | 分子式 | 同系列差 |
| 1 | CH[XB]4[/XB] | CH[XB]2[/XB] |
| 2 | C[XB]2[/XB]H[XB]6[/XB] | |
| 3 | C[XB]3[/XB]H[XB]8[/XB] | CH[XB]2[/XB] |
| 4 | C[XB]4[/XB]H[XB]10[/XB] | CH[XB]2[/XB] |
| 5 | C[XB]5[/XB]H[XB]12[/XB] | CH[XB]2[/XB] |
| … | … | |
| n-1 | CnH[XB]2(n-1)+2[/XB] | CH[XB]2[/XB] |
| n | C[XB]n[/XB]H[XB]2(n+2)[/XB] |
从表11-1可见,任何相邻的两个烷烃在分子组成上都相差CH2,这叫做同系列差。这样的一系列化合物叫做同系列。同系列中的化合物互称同系物。同系列在有机化学中的重要性在于同系物具有相似的化学性质,其物理性质一般随碳原子数目的增减表现出有规律的变化,对学习及研究有机化合物带来了很大方便。但是,如果碳原子数目相差过多,其性质也会表现出较大的差异。因此,在运用同系物的概念时,既要考虑到它们的共性,也要注意其个性。
从同系列中可以看出,烷烃分子中的碳和氢原子数间有一定的关系。如果碳原子数为n,则氢原子数即为2n+2。因此,烷烃的分子组成通式是CnH2n+2。
三、烷烃的同分异构现象和构象
(一)碳链异构
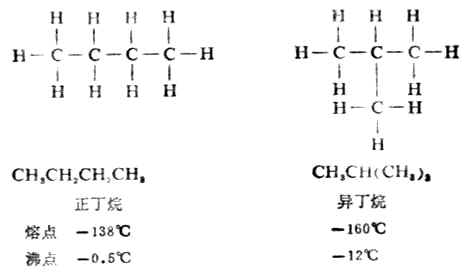
一种物质只能有一种特定的构造。因此,要了解有机物的特性和反应,常常要研究它们的构造。在研究烷烃的同系列时,发现随着碳原子数的逐渐增加,会出现同分异构现象。例如:分子式为C4H10的烷烃,碳原子的连结方式有两种可能,其构造式分别为:
分子式为C5H12的烷烃,碳原子的连结方式则有三种可能,其构造式分别为:
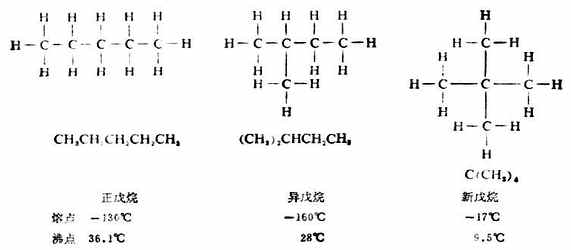
像这样具有相同的分子式,而有不同的构造的化合物互称同分异构体,简称异构体。若分子式相同,由于碳链构造的不同而产生的异构体叫做碳链异构体,例如,正丁烷和异丁烷;正戊烷、异戊烷和新戊烷。这种异构现象由于组成分子的原子或原子团连结次序不同引起的,所以属于构造异构。随着分子中碳原子数目的增加,同分异构体的数目会很快地增加,如表11-2。
表11-2 随着碳原子的增加异构体数目增长的情形
| 碳原子数 | 分子式 | 异构体数目 | |
| 1 | CH4 | ||
| 2 | C2H6 | ||
| 3 | C3H8 | ||
| 4 | C4H10 | 2 | |
| 5 | C5H12 | 3 | |
| 6 | C6H14 | 5 | |
| 7 | C7H16 | 9 | |
| 8 | C8H18 | 18 | |
| 9 | C9H20 | 35 | |
| 10 | C10H22 | 75 | |
| 15 | C15H32 | 4 347 | |
| 20 | C20H42 | 366 319 | |
| 40 | C40H82 | 62 491 178 805 831 | |
烷烃中碳链构造的不同主要是由碳原子之间的结合方式的不同引起的。在烷烃中碳原子与碳原子之间可能有四种结合方式,因此把碳原子分为伯(以1°表示)、仲(2°)、叔(3°)、季(4°)四类。 .
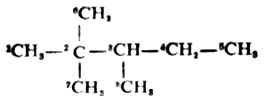
只与另外一个碳原子直接相连的碳原子,如上式中的C-1,5,6,7,8叫做伯碳原子;若碳原子与另外两个碳直接相连如-4,叫做仲碳原子;与另外三个碳原子直接相连的碳如C-3叫做叔碳原子;与另外四个碳原子直接相连的碳如C-2叫做季碳原子。
连在伯、仲和叔碳原子上的氢,分另称为伯、仲和叔氢原子。不同类型的氢原子的反应性不同。
(二)构象
有机物的分子中,以单键(σ键)相连结的两个碳原子,通过沿C-C单键的旋转,可使这两个碳原子上的原子或原子团在空间有不同的排布方式。每一种排布方式,都是有机物分子在空间的一种构象。具有一定构型的分子,仅由于围绕单键旋转,使分子中各原子在空间有不同的排布,称为构象。
1.乙烷的构象
乙烷是含有碳碳单键的最简单的化合物。当两个碳原子围绕C-C键旋转时,两个碳原子上的两组原子之间可以相对处于不同的位置,出现无数的空间排布方式,每一种空间排布方式就是一种构象。
不同的构象可用透视式或纽曼投影式表示。(Ⅰ)和(Ⅱ)是乙烷的两种典型构象。
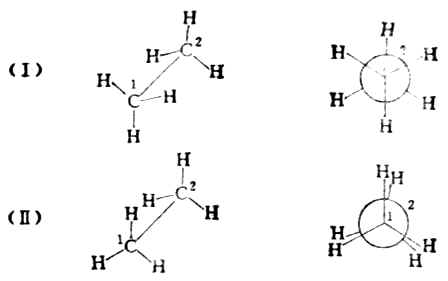
纽曼投影式中,离观察者较远的碳原子用圆圈表示,它的三个C-H键用圆圈上的实线表示;离观察者较近的碳原子用圆心的点表示,它的三个C-H键则用与圆心相连的三条实线表示。
(Ⅰ)式中两组氢原子处于交叉的位置,这种构象叫做交叉式。式中两组氢原子彼此相距最远,相互斥力最小,能量最低,因而稳定性最大。这种构象是优势构象。(Ⅱ)式中,两组氢原子两两相对重叠,这种构象叫重叠式。在重叠式构象中,非键合氢原子间距离最近,排斥作用最大,这种构象具有较高的内能,是一种不稳定的构象。在室温时,乙烷分子是交叉式、重叠式以及介于它们两者之间的许多构象的平衡混合物,不易分离。
2.正丁烷的构象
正丁烷
的构象要比乙烷复杂。当围绕正丁烷的C(2)-C
(3)键旋转时,可以有全重叠式,邻位交叉式、部分重叠式和对位交叉式等不同的典型构象。它们的透视式和纽曼投影工表示如下;
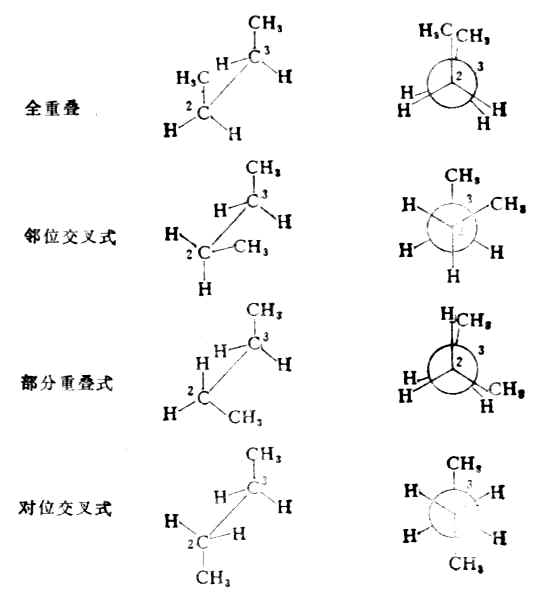
透视式 纽曼投影式
在正丁烷的构象中,对位交叉式的两个甲基相距最远,相互作用最弱,内能最低,是最稳定的现象。邻位交叉式的两个甲基相距较近些,所以稳定性稍差。部分重叠式的甲基和氢原子十分靠近,相互作用大,稳定性较邻位交叉式差。而在全重叠式中,由于两个甲基处于十分靠近的地位,相互作用最大,稳定性最差。因此这几种构象的内能高低次序为:全重叠式>部分重叠式>邻位交叉式>对位交叉式。
可见,正丁烷在一般情况下,对位交叉式是占优势的构象。
在链状化合物中,优势构象都是类似于正丁烷对位交叉式的构象。应该注意,分子主要以其优势构象存在,并不意味着其它的构象不存在,而是所占比例较小而已。
四、烷烃的命名
有机化合物的种类繁多,数目庞大,又有许多异构体。所以必须有一个合理的命名法,以便于识别。有机化合物的正确的名称不仅应表示分子的组成,而且要准确、简便地反映出分子的构造。因此命名法是有机化学的重要内容之一。烷烃的常用命名法有普通命名法和系统命名法。
(一)普通命名法
1.直链烷烃的命名
直链烷烃按碳原子数叫“正某烷”。十个及十个碳原子以下的烷烃分别用天干(甲、乙、丙、丁、戊、己、庚、辛、壬、癸)表示。例如,CH4四烷,C2H6乙烷,C3H8丙烷……C10H22癸烷。对含有十个碳原子以上的烷烃用汉语数字命名。例如,C11H24十一烷,C12H26十二烷,C20H42二十烷等。
2.含侧链烷烃的命名
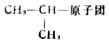
且无其它支链的烷烃,则按碳原子总数叫做异某烷。例如,

(二)系统命名法
对构造比较复杂的化合物的命名可采用系统命名法。系统命名法可用于各种化合物的命名。
1.烷基
烃分子中去掉一个氢原子所剩下的原子团叫烃基。脂肪烃去掉一个氢原子所剩下的原子团叫做脂肪烃基,通常用R表示。烷烃的基叫做烷基,它的通式CnH2n+1烷基的命名根据烷烃而定。多于两个碳原子的烷烃,有可能衍生出多个不同的烷基。例如:
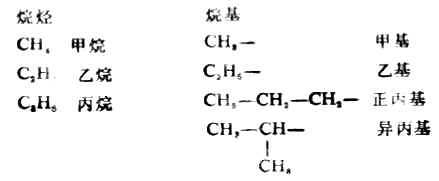
2.系统命名法
我国现用的系统命名法是根据IUPAC(International Union of Pure and Applied Chemistry)规定的原则,再结合我国汉语文字的特点而制定的。烷烃的系统命名法的主要之点是如何确定主链和处理取代基的位置。
(1)选择最长的连续的碳链为主链作为母体,叫某烷。较短的链为支链,作为取代基。
(2) 从靠近支链的一端开始,把母体烷烃的各个碳原子依次编号,以确定取代基的位次。取代基的位次号与名称之间用一短线相连,写在母体名称之前。例如:
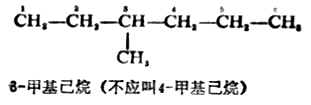
(3)主链上连接几个不同的取代基时,则按“次序规则”(见本章第二节)将取代基的大小顺序列出,小者在前,“较优”者在后。
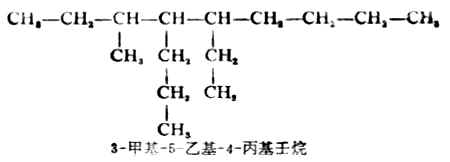
(4)若在主链上连有相同的取代基,则将取代基合并,用二、三……数字表示取代基的数目,写在取代基前面,各取代基的位次号仍须标出。例如:

(5)若同时可能有几个等长的主链时,要选择含取代基最多的碳链为主链。例如:
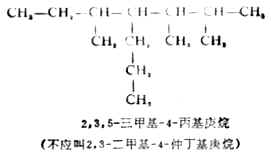
(6)若在主链的等距离两端同时遇到取代基且多于两个时,则要比较第二个取代基的位次大小,以取代基位次的代数和最小为原则。例如:
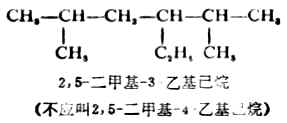
五、烷烃的物理性质
在有机化学中,物理性质通常是指化合物的聚集状态、气味、熔点(mp)、沸点(bp)、密度(ρ)、折射率(nΧD)、溶解度以及波谱数据等。
在室温和常压下,直链烷烃中从甲烷到丁烷都是气体;含5-15个碳原子的烷烃是液体;16及16个碳原子以上的是固体。不仅物态随着正烷烃同系物相对分子质量的增加而有明显的改变,其它一些物理性质如熔点、沸点、密度、折射率也呈现出规律性的变化。
从表11-3可以看出,正烷烃的熔点(前三个除外)和沸点基本上都是随着碳链的增长而变大。这是一个“量的变化会引起质的变化”的例证。
表11-3 正烷烃的物理常数
| 名称 | 熔点 | 沸点/℃ | 相对密度 | 折射率(n20D) |
| 甲烷 | -183 | -164 | 0.4661 | - |
| 乙烷 | -183 | -89 | 0.5462 | - |
| 丙烷 | -187 | -42 | 0.5853 | - |
| 正丁烷 | -138 | -0.5 | 0.5788 | - |
| 正戊烷 | -130 | 36 | 0.6262 | 1.3575 |
| 正己烷 | -95 | 69 | 0.6603 | 1.3751 |
| 正庚烷 | -91 | 98 | 0.6838 | 1.3878 |
| 正辛烷 | -57 | 126 | 0.7025 | 1.3974 |
| 正壬烷 | -51 | 151 | 0.7179 | 1.4054 |
| 正癸烷 | -30 | 174 | 0.7300 | 1.4102 |
| 正十一烷 | -26 | 196 | 0.7402 | 1.4172 |
| 正十二烷 | -10 | 216 | 0.7487 | 1.4216 |
| 正十三烷 | -6 | 235 | 0.7564 | 1.4256 |
| 正十四烷 | 6 | 254 | 0.7628 | 1.4290 |
| 正十五烷 | 10 | 271 | 0.7685 | 1.4315 |
| 正十六烷 | 18 | 287 | 0.7733 | 1.4345 |
| 正十七烷 | 22 | 302 | 0.7780 | (1.4369) |
| 正十八烷 | 28 | 316 | 0.7768 | (1.1390) |
| 正十九烷 | 32 | 330 | 0.7855 | (1.4529) |
烷烃的熔点变化没有沸点那样有规律,通常是随着分子的对称性增大而升高。分子越对称,它们在晶体中的排列越紧密,熔点就高。例如,正戊烷、异戊烷、新戊烷的熔点分别为-130℃、-160℃、-17℃。新戊烷的熔点最高。
烷烃的相对密度都小于1,且随着相对分子质量的变大而有所增加,最后接近于0.80左右。这也是由于分子间的作用力随着相对分子质量的增加而加大,使分子间的距离相对地减小,密度增大。
烷烃都不溶于水,但能溶于苯、氯仿、四氯化碳等有机溶剂。它们的溶解度随着相对分子质量的增加而减小。
六、烷烃的化学性质
烷烃的分子中没有官能团。除甲烷只有C-Hσ键外,所有烷烃分子中仅含C-C及C-Hσ键。
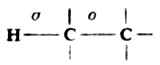
由于烷烃分子中的C-C键和C-H键都很强,需要较高的能量才能使之断裂(如断裂C-Cσ键需347.3kJ·mol-1,断裂C-Hσ键需380.7-435.1kJ·mol-1),所以一般情况下,烷烃具有极大的化学稳定性,与强酸、强碱及常用的氧化剂、还原剂都不发生化学反应。另外,碳原子和氢原子的电负性差别很小,分子中σ键的极性很弱,很难被极化,故烷烃的分子也不易和极性试剂发生共价键异裂的离子型反应。但是,在一定的条件下,例如使用高温、高压或催化剂,烷烃也能发生一些化学反应。
(一)卤化反应
烷烃和氯在黑暗中几乎不起反应。但是在日光照射、高温或催化剂的影响下它们能发生剧烈的反应,生成氯化氢和氯代烷烃。例如甲烷和氯气在强烈的日光或紫外光照射下反应猛烈,甚至发生爆炸。
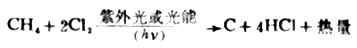
在漫射的日光下则起一般的氯化反应,生成一氯甲烷、二氯甲烷、三氯甲烷(俗称氯仿)和四氯化碳。

烷烃的氯化过程是逐步的。每一步被取代出来的氢原子与另一个氯原子化合成为氯化氢。

较高相对分子质量的烷烃氯化时,常生成复杂的混合物。
(二)氧化反应
烷烃在通常情况下是不被氧化的。但是它能在空气中燃烧(剧烈氧化)生成二氧化碳和水,同时放出大量的热能。因此烷烃可以用作燃料。
C[XB]2[/XB]H[XB]6[/XB]+3*1/2*O[XB]2[/XB]→2CO[XB]2[/XB]+3H[XB]2[/XB]O △H=-1426kJ.mol[SB]-1[/SB]
C[XB]6[/XB]H[XB]14[/XB]+9*1/2*O[XB]2[/XB]→6CO[XB]2[/XB]+7H[XB]2[/XB]O △H=-4141kJ.mol[SB]-1[/SB]
一些气态烃或极细微粒的液态烃与空气在一定比例范围内混合,点燃时会发生爆炸。煤矿井的瓦斯爆炸就是甲烷与空气混合物(体积比约为1:10左右)燃烧时造成的。
七、烷烃氯化的反应历程
化学反应历程是说明一个化学反应所经历的过程,也就是对每一个化学反应的各个中间步骤的详细描述。
已知烷烃的氯化反应是一种自由基反应。反应过程中,反应物的共价键发生均裂,生成自由基。一般地说自由基很不稳定,极易与其它化合物的分子发生反应,使自己变成稳定的分子,又使其它化合物的分子变为自由基,从而引起一连串反应(链反应)。例如,氯分子在光照下,均裂为氯自由基。
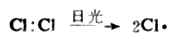
反应由此开始,所以这个步骤叫做链的引发。氯自由基很活泼,它夺取甲烷分子中的氢结合为氯化氢,产生甲基自由基。
Cl·+CH[XB]4[/XB]→CHl+CH[XB]3[/XB]·
CH3·和CL2反应,夺得一个氯原子,生成稳定的CH3CL,同时又有一个新的CL·产生。
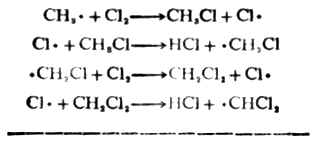
这个过程叫做链的增长。反应过程表明,只要在开始时有少量的氯原子(自由基),反应即会继续传递下去。
最后由于自由基相互结合形成稳定的化合物,反应便终止。如:
Cl·+Cl·→Cl[XB]2[/XB]
CH[XB]3[/XB]·+Cl·→CH[XB]2[/XB]Cl CH[XB]3[/XB]·+CH[XB]3[/XB]·→CH[XB]3[/XB]-CH[XB]3[/XB]
上述过程叫做链的终止。
八、几种常用的烷烃混合物
常用的烷烃混合物,除了汽油、煤油和柴油外,还有以下几种产品。
(一)石油醚
石油醚是低级烷烃的混合物。沸点范围在30-60℃的是戊烷和己烷的混合物;沸点范围在90-120℃的是庚烷和辛烷的混合物。它们主要被用作有机溶剂。石油醚极易燃烧并具有毒性,使用及贮存时要特别注意安全。
(二)液体石蜡
液体石蜡主要成分是18-24个碳原子的液体烷烃的混合物,是呈透明液体。它不溶于水和醇,能溶于醚和氯仿中。液体石蜡性质稳定。精制的液体石蜡在医药上常用作肠道润滑的缓泻剂。
(三)凡士林
凡士林是液体石蜡和固体石蜡的混合物,呈软膏状半固体,不溶于水,溶于醚和石油醚。因为它不能被皮肤吸收,而且化学性质稳定,不易和软膏中的药物起变化,所以在医药上常用作软膏基质。
(四)石蜡
石蜡是C25-C34固体烃的混合物,医药上用作蜡疗、药丸包衣、封瓶、理疗等。
