第三节 FCM对外周白细胞的免疫荧光分析
外周血是临床检验中的重要标本。FCM分析外周白细胞的主要目的是了解各种白细胞的数目与分群情况。这些数字的变化与临床的某些疾病有一定的关系。近年来,由于多种识别白细胞膜表面抗原的单克隆抗体的发现,以及对这些单克隆抗体的直接或间接荧光标记物的出现,使得利用FCM的荧光组织化学分析获得被测细胞的多指标的更多、更准确的信息,这无疑对警觉临床和科研有很大帮助。本节 主要讨论有关外周血的白细胞的免疫荧光标记技术、数据分析及临床应用等方面的问题。
一、白细胞的免疫荧光标记技术
1.白细胞抗原下面给出世界卫生组织对白细胞抗原的统一命名,以及它们的分子量、对应的单克隆抗体及反应阳性的细胞(见表10-2)。
表10-2 WHO对白细胞分化抗原的命名
| 抗原 | 分子量 | 单克隆抗体 | 反应阳性细胞 |
| CD[XB]1[/XB] | P45/12 | Leu[XB]6[/XB],T[XB]6[/XB],OKT[XB]6[/XB] | 胸腺细胞、朗格罕细胞 |
| CD[XB]2[/XB] | P50 | Leu[XB]5[/XB]B,T[XB]11[/XB],OKT[XB]11[/XB] | E玫瑰花受体、T和NK细胞 |
| CD[XB]3[/XB] | P19-29 | Leu[XB]4[/XB],T[XB]3[/XB],OKT[XB]8[/XB] | T细胞 |
| CD[XB]4[/XB] | P55 | Leu[XB]3[/XB],T[XB]4[/XB],OKT[XB]4[/XB] | 协助—诱导T细胞,单核细胞 |
| CD[XB]5[/XB] | P67 | Leu[XB]1[/XB],T[XB]1[/XB], T[XB]101[/XB] | T细胞、B细胞亚群,慢粒(淋巴性) |
| CD[XB]6[/XB] | P120 | T[XB]12[/XB] | T细胞 |
| CD[XB]7[/XB] | P41 | Leu[XB]9.3[/XB]A | T,T—ALL[SB]a[/SB]和NK细胞 |
| CD[XB]8[/XB] | P32-33 | Leu[XB]2[/XB],T[XB]6[/XB],OKT[XB]8[/XB] | 抑制-细胞毒T细胞、NK细胞 |
| CD[XB]9[/XB] | P24 | BA-2 | 淋巴细胞白血病相关抗原 |
| CD[XB]10[/XB] | P100 | CALLA, J[XB]5[/XB] | 粒细胞、前B白血病细胞 |
| CD[XB]11[/XB] | P170/95 | CR[XB]3[/XB]/Leu[XB]15[/XB],OKM[XB]1[/XB] | 单核细胞、粒细胞、NK细胞 |
| MO[XB]1[/XB] | T细胞亚群(C[XB]3[/XB]bi受体) | ||
| CD[XB]15[/XB] | LNFP-I | LeuM[XB]1[/XB] | 单核细胞、粒细胞、激活的T细胞 |
| CD[XB]16[/XB] | P50~70 | Leu[XB]11[/XB] | NK细胞、粒细胞(IgGFc受体) |
| CD[XB]19[/XB] | P95 | Leu[XB]12[/XB],B[XB]4[/XB] | B、CLL[SB]b[/SB]前B-ALL细胞 |
| CD[XB]20[/XB] | P35 | Leu[XB]16[/XB],B[XB]1[/XB] | B细胞 |
| CD[XB]21[/XB] | P140 | CR[XB]2[/XB],B[XB]7[/XB] | B细胞、C[XB]3[/XB]a受体细胞 |
| CD[XB]22[/XB] | P135 | Leu[XB]41[/XB] | B、CLL、和毛细胞白血病细胞 |
| CD[XB]23[/XB] | P45 | Blast[XB]2[/XB] | |
| CD[XB]24[/XB] | P45,P55 | BA-1 | B、CLL和前B-ALL细胞 |
| CD[XB]25[/XB] | P65 | IL-2受体 | 数分裂因子激活的T细胞HTLV-I、II、感染细胞 |
a:急性淋巴细胞性白血病;b:慢性淋巴细胞性白血病。
2.样品的制备供FCM分析的样品是单细胞悬液,而且大部分样品都需经荧光染色。样品的制备方法大致有三种:①用荧光单克隆抗体染全血,随后溶解红细胞;②红细胞溶解后染色;③通过梯度离心法分离出单个淋巴细胞和单核细胞,再将之制成细胞悬液染色。
(1)全血染色后溶解红细胞:由于不少血液标本具有生物危害性,用此方法可以将染色、溶解、固定、分析几个步骤都在一个试管内进行,这样减少转换过程中的污染。而且此法比用梯度离心分离出单个核细胞更节 省时间。由于此法未将粒细胞去除,故在用FCM分析时,要注意排除粒细胞的干扰。
具体操作步骤如下:
①全血100~150μl,放入5ml试管,并用50~100μl PBS稀释,总体积为200μl。]
②荧光标记的单克隆抗体染色30min,4[SB]℃[/SB](或放于冰上)。单克隆抗体的浓度因不同来源差异很大,但为了使用方便,可按其说明书配成每次实验使用10μl。注意蔽光。
③用3~4μl冷BPS清洗。离心250×g(约每分钟1500转),5min,洗3次。注意每次用吸管将上清吸出,决不能倾倒去液!
④用2ml氯化铵液(配法见下)在室温下溶解红血球,约10min。若红细胞完全被溶解,溶液由混浊变到透明。注意溶解程度的掌握十分重要:若溶解过分,则导致白细胞上抗原被破坏,或者某些敏感的细胞死亡而导致比例的改变。若溶解不彻底,大量红细胞会影响对淋巴细胞的分析。这是因为淋巴细胞在分析图像上与红细胞群接近,在框出淋巴细胞群时,会把部分红细胞框定于淋巴细胞内。而红细胞溶解不足或过度在很大程度上影响着分析结果。
【氯化铵液的配制】
Tris—氯化铵1×氯化铵
0.16mol/L NH[XB]4[/XB]Cl 0.38g/100ml 90ml0.16mol/LNH[XB]4[/XB]Cl
0.17mol/L Tris 2.06g/100ml 10ml0.17mol/l Tris
pH值7.56 pH值7.2
⑤红细胞被彻底溶解,加入1mlPBS稀释的0.5%甲醛,立即离心,洗3次,条件同步骤③。加入甲醛的目的是尽早固定细胞和细胞上的抗原,避免有生物危害的标本到处污染。
⑥将染色完成的细胞悬浮于0.5~1ml的0.1%甲醛溶液内。置4[SB]℃[/SB],蔽光,等待分析。经固定后的细胞在冰箱内可保存一周,这样对工作的安排会带来方便。
(2)红细胞被溶解后再对白细胞染色:此方法的优点是可以了解被染白细胞的数量以及存活率。但由于有时有些标本比较敏感,溶解红细胞后,还要经过多个染色步骤,这样容易造成抗原的丧失。此法具体步骤如下:
①室温下放入14ml氯化铵在15ml的试管里。
②加入0.5~1ml全血,混合3~5min。
③立即离心100~150×g,并用PBS洗2次。
④白细胞计数,注意存活率应在90%以上。做成每毫升含5×10[SB]6[/SB]白细胞悬浮液。将细胞分配到5ml的试管,每试管0.2ml,即1×10[SB]6[/SB]个细胞。
⑤荧光标记的单克隆抗体染色30min,4[SB]℃[/SB],避光。抗体浓度配制如前所述。
⑥PBS洗3次后,用0.5%甲醛固定。方法如前。
(3)用Ficoll—Hypaque梯度离心法分离出单个核细胞:用此法可以分离骨髓细胞、淋巴结、扁桃体捣碎后的单细胞悬液等。血液标本应有抗凝剂。取血到分离不能超过6h。
①抗凝全血4~20ml,用等量PBS或Hanks液稀释。
②稀释血8或40ml置于15或50ml离心管内,4或10ml Ficoll—Hypaque(或者等量的其它分离液,比重为1.007)从离心管底部轻轻加入到血的下面。这种方法对血的扰动较小,比将全血加到Ficoll上面为好。加完后,可以清楚看到Ficoll与全血之间有一明显的分界线。注意在Ficoll快加完时应特别小心,否则有可能加入气泡搅混血样,使血与分离液混合,达不到分离的目的。
③离心350~400g,30min。红细胞、粒细胞以及死细胞将位于离心管底部,中间层的单个核细胞为淋巴细胞、单核细胞和一些血小板。
④取出中间层中所有细胞,若在Ficoll中还有细胞也要取出,这也是单个核细胞(PBMC)。
⑤用PBS洗3次,第1次清洗时,可用较快速400×g离心10min。因为有可能中间层中混有一些ficoll,比重增加而细胞不易沉降。
⑥PBMC计数,注意存活率应高于90%。配成5×10[SB]6[/SB]个/ml的细胞悬浮液。
⑦取出0.2ml的悬浮液加入到5ml试管(内含1×10[SB]6[/SB]细胞),用荧光标记的单克隆抗体染色,方法如前。洗3次后固定。注意必须先染色后固定,固定后的细胞膜通透性改变,会导致荧光标记的抗体进入细胞中去,而在显微镜下观察的染色效果则和死细胞一样。当用FCM分析时,则均为阳性而达不到检验目的。这也是用FCM分析的细胞存活率应高于90%的原因。
(4)荧光标记抗体的细胞染色:如前所述,FCM分析被荧光标记的抗体染色的细胞,在选择荧光染料时必须注意这些荧光染料所需要的激发光波长是否与所使用的FCM的激发光谱相匹配。一般各个公司所采用的绿色荧光染料为FITC,而选用的红色荧光染料却不尽相同,有的用TRITC,有的用藻红蛋白(PE),所需要的激发光谱就不一样,因而若因匹配不当则会招致荧光抗体所染的细胞分析不出来,这是应该注意的。
这里的标本染色方法和免疫荧光法相同。下面仅说明一些具体的注意事项:
①在用间接法染色时,染色步骤依次为第一抗体→清洗→第二抗体→清洗→红细胞溶解。为了实验的方便,将第二抗体也配成每次实验用10μl。
②双色法:双色法多用于直接染色法。将分别用FITC和PE标记的抗体各10μl置入同一个含有约1×10[SB]6[/SB]/0.2ml的试管内,30min,4℃避光。然后清洗、固定。
目前不少制备单克隆抗体的公司已将比值有意义的两种抗体,分别用红、绿荧光染料标记后,制成一种试剂。如CD[XB]2[/XB]—FITC/CD[XB]20[/XB]—PE;CD[XB]4[/XB]-FITC/CD[XB]8[/XB]-PE等。可按说明使用,具体用量为每次实验10μl。
③对照组:众所周知,免疫组化的染色过程中,阴性和阳性对照是必不可少的。在准备用FCM分析的细胞时,对照标本的制备显得格外重要。因为一次用FCM分析的样品可能会很多,甚至多达上百个试管。对同一病人也可能会用到20~30个不同的单克隆抗体。每一个病人都要有相应的阴性对照。阴性对照主要用于仪器分析细胞之前,设立阴性和阳性的分界线。阳性对照主要用于检查染色方法。阳性对照细胞选自那些已知的细胞和已知的单克隆抗体中的阳性反应最明显者。阴性对照细胞有以下几种:
1)非染色细胞:直接染色法时,用10μlPBS代替与荧光结合的单克隆抗体,其它步骤相同。间接染色法时,分别用10μl的PBS代替第一抗体和荧光第二抗体,其它步骤相同。
2)使用非特异性的抗小鼠膜表面免疫球蛋白(MsIg),代替特异性的单克隆抗体。这是由于所使用的单克隆抗体来自小鼠,可能造成非特异性的假性反应,因此使用MsIg作为对照。同时还需要注意选择与实验用单克隆抗体亚类一致的MsIg。如大部分单克隆抗体为IgG1,也有部分抗体为IgM,所以用MsIg作对照组时,往往使用MsIgG和MsIgM两种。直接染色法时,用10μl与荧光结合的MsIg,代替荧光单克隆抗体。间接染色时,用10μl无荧光的MsIg代替第一抗体。其它步骤与实验组相同。
3)双染色对照:将各10μl 的分别与红荧光染料和绿荧光染料结合的MsIgg 或MsIgM,加入到同一个试管,代替荧光的特异性单克隆抗体,其它步骤相同。
4)间接法对照:用10μl的PBS代替第一抗体。荧光第二抗体的浓度和使用量均与其它实验相同,其它实验步骤也和实验组相同。
二、白细胞免疫荧光分析的数据分析
在仪器调试和校准及标本制备完毕之后,就要做测试和数据分析工作。这里先讨论一下有关数据测量和分析的技术问题,而一些医学应用的具体参数的测量和分析后面做介绍。
1.0[SB]。[/SB]散射和90[SB]。[/SB]散射的双指标的二维图像分析可以把0[SB]。[/SB]和90[SB]。[/SB]散射分别选作二维图像的X轴和Y轴指标。通过图中数据点分布把全血分为淋巴细胞、单核细胞和粒细胞几个亚群(图10-9)。
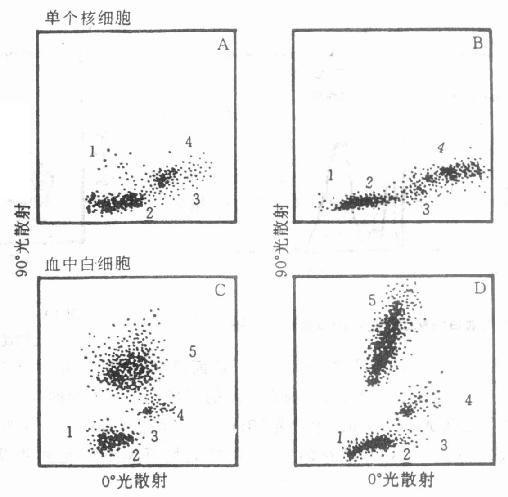
图10-9 人的外周血白细胞分群的二维点图
图中,A、B图的淋巴细胞数大约有6000~9000个;C、D图约有2000~4000个。分群编号依次表示:①红细胞、死细胞和渣滓;②淋巴细胞群;③大颗粒淋巴细胞;④单核细胞;⑤粒细胞。数据是对1000个细胞分析得到的。
若用单指标直方图,对PBMC而言,可以把淋巴细胞和单核细胞分开。见图10-10中的A、B图。但对红细胞溶解后的全血,单指标图分辨率则不够了(图10-10的C、D图),图A、B给出的是经ficoll后的PBMC;图C、D给出的是人外周血白细胞。图中数字编号所代表的组分和图10-9相同。
由上可见,在分析红细胞溶解后的全血时,必须先采用双指标二维点图。从图上也可清楚地看出,粒细胞、未被溶解的红细胞和一些渣滓,由于不同的体积和致密度,明显地区别于淋巴细胞和单核细胞从而能把它们分开。看到清楚的细胞分群以后,可以在计算机的显示屏上将所要分析的细胞画线框出,并通过指令送入存贮器,以后就可只对框出部分做各种数据分析和深入考查。图10-11就是对双指标点图上的淋巴细胞群框定的示意图。数字所表示的意思和图10-9相同。
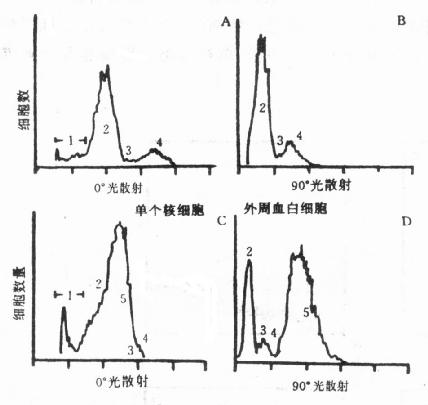
图10-10 外周血白细胞及PBMC的单指标直方图
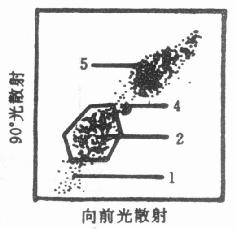
图10-11 双指标点图上细胞的框定
2.单维直方图上阴性分界游标设置前面已经强调,在用FCM分析时,阴性对照是必不可少的。首先用非染色细胞,根据前面介绍的双指标二维点图的办法,将某一细胞群框定;然后分别选用绿色荧光(GFL)和红色荧光(RFL)单指标直方图。在直方图上所出现的细胞均为阳性。可用改变GFL和RFL增益的办法,将细胞恰好调节 到左侧并设立游标(图10-12)。
然后再测试MsIg染色的阴性对照。某些细胞,由于膜上的Fc受体可以与对照抗体鼠Ig非特异性结合,因而有一定的背景染色,不过这种阳性百分率不应超过5%。所以MsIg与非染色细胞的分界游标确立后,以后所测试的标本以此为标准,游标位置基本不变。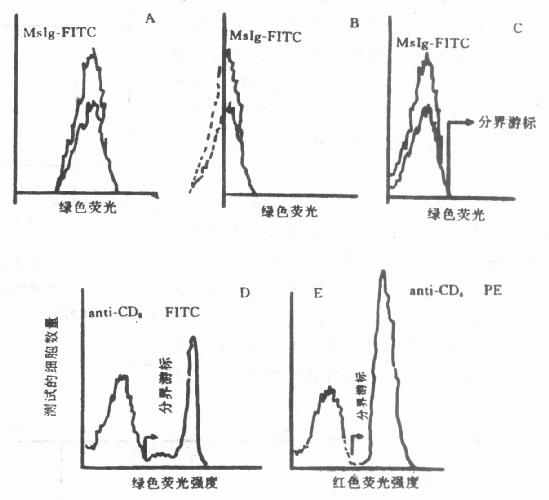
图10-12 阴阳性细胞分界游标的设置
MsIg的红、绿荧光阴阳性分界游标确立以后,可以测试实验标本。首先检查细胞分群情况,然后检查淋巴细胞群是否落在已输入计算机的淋巴细胞框定的范围里。若染色及FCM的工作性能都正常,则框定的位置不会改变。然后转换成荧光直方图。若为FITC标记的细胞,则GFL为X轴;若为PE标记的细胞,则用RFL为X轴。由于阴阳性分界游标记已确立,细胞阳性率及图像均显示于计算机荧光屏上;同时也可选用其它指标和图像、打印所需的资料等。
3.双染色分析游标设立和荧光校正
(1)游标的设立:游标设立的原理和单染并无不同,但具体要用二维点图和二维等高图来完成。分别选用GFL和RFL为X和Y轴。先用不染色细胞测试,将阴性细胞集中在左下角(图10-13)。分别为X、Y轴设立游标,再用MsIg的阴性对照测试。可将X、Y轴游标略为移动,使位于窗“3”内的细胞(阴性)在95%以上。
(2)红、绿荧光的校正:由于红色荧光探测器在最佳测试状态时,会让部分绿色荧光进入红色荧光探测器。这是因为一部分细胞发出的绿色荧光波长较长。若用阻断或滤色的办法消除进入红荧光探测器的这部分GRL,就会大大地降低RFL探测器的灵敏度。因而只好在操作时,通过电子计算机预先进入荧光校正,在RFL中适当扣除GRL的影响。
通常红色荧光进入绿色荧光探测器的情况比较光见,图10-14给出CD[XB]11[/XB]-PE(T细胞、RFL)及CD[XB]8[/XB]-FITC(T抑制细胞,GFL)双染细胞在二维等高图上进行荧光校正的示意图。X轴为GFL,Y轴为RFL,由X轴Y轴游标划分的四个窗的阴阳性和图10-13相同。各窗给出的百分数为该细胞群所占百分比。图A表示未经校正时的情形。窗“2”内31.46%表示双阳性细胞,即在T细胞中31.46%为抑制细胞毒细胞。经过适当校正,可见有两群阳性双标记细胞出现(B图)。高强度部分为真正的CD[XB]8[/XB]、CD[XB]11[/XB]双标记阳性细胞;低强度部分属于CD[XB]8[/XB]绿色阳性细胞(NK细胞)。此时“2”窗中细胞份额减为7.59%。需要指出的是校正过度则会使各区的阳性细胞都减少(图C)。
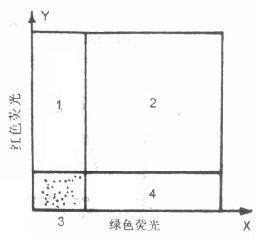
图10-13 双染色二维点图上游标的设置
1区:红色荧光阳性;2区 :红、绿荧光均为阳性;3区:阴性细胞:4区:绿色荧光阳性细胞
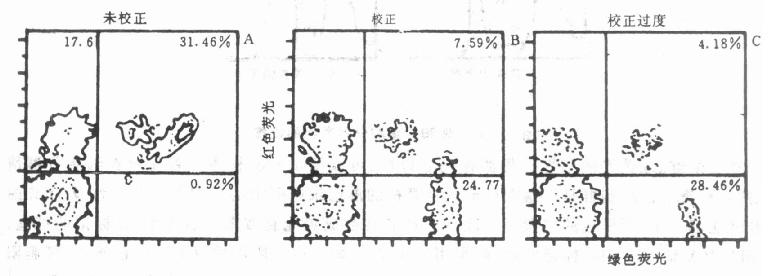
图10-14双染色在二维等高图上荧光校正
双染色的荧光校正是用电子补偿电路来完成的。补偿时先测定一种染料的荧光,此时除了应该接收该荧光的光电倍增管PMT[XB]1[/XB]有信号输出外,另一光电倍增管PMT[XB]2[/XB]也常会有微弱输出。调节 补偿器使PMT[XB]2[/XB]的输出为0;然后再测另一种波长的荧光染料,调PMT[XB]1[/XB]的补偿器使之输出也为0;然后再测另一种波长的荧光的染料,调PMT[XB]1[/XB]的补偿器使之输出也为0:如此反复调节 ,使两种荧光的探测器都获得补偿。实际调节 时用的是一种标准荧光微球,微球上标有已知数量的荧光分子。利用不同的微球可调整、补偿不同荧光的测量通道。需要指出的是:当PMT高压有所改变、激光和滤片系统有所变动时,都要对荧光校正做重新补偿调节 。
三、淋巴细胞亚群的测定及其在临床医学中的实用意义
淋巴细胞由于表面特异性抗原的差异可分为四大类(表10-3),这些不同抗原表现型的亚群执行不同的机能。而且某些疾病会选择性地损伤某些亚群而造成亚群之间的比例失调。根据FCM双荧光分析的结果,现将不同的抗原和不同的机能的淋巴细胞亚群列于表10-4。
表10-13 主要淋巴细胞亚群的表面抗原
| 细胞表面抗原的类型 | 抗原表现的细胞 | |||
| T协助、诱导细胞 | T抑制、T细胞毒细胞 | NK细胞 | B细胞 | |
| 独特的 | ||||
| CD[XB]3[/XB](Leu[XB]4[/XB]) | + | + | - | - |
| CD[XB]4[/XB](Leu[XB]3[/XB]) | + | - | - | - |
| CD[XB]8[/XB](Leu[XB]2[/XB]) | - | + | -/+ | - |
| CD[XB]16[/XB](Leu[XB]11[/XB]) | - | - | + | - |
| CD[XB]19[/XB](Leu[XB]12[/XB]) | - | - | - | + |
| 限制性的 | ||||
| Leu[XB]7[/XB] | -/+ | -/+ | +/- | - |
| Leu[XB]8[/XB] | +/- | +/- | -/+ | +/- |
| CD[XB]7[/XB](Leu[XB]9[/XB]) | +/- | + | +/- | - |
| CD[XB]11[/XB](Leu[XB]15[/XB]CR[XB]3[/XB]) | -/+ | -/+ | + | - |
+:表现的抗原;-:未表现的抗原;+/-:主要亚群有表现的抗原;-/+:抗原仅表现于少数亚群。
表10-14 淋巴细胞机能性亚群
| 细胞群 | 细胞机能 | 测试的单克隆抗体 |
| T细胞 | 协助细胞 | Leu[SB]3+[/SB]8[SB]-[/SB] |
| 抑制细胞—诱导细胞 | Leu[SB]3+[/SB]8[SB]+[/SB] | |
| 细胞毒细胞 | Leu[SB]2+[/SB]15[SB]-[/SB] | |
| 抑制细胞 | Leu2[SB]+[/SB]15[SB]-[/SB] | |
| 抑制作用 | ||
| 抑制—诱导细胞 | Leu3[SB]+[/SB]8[SB]+[/SB] | |
| 抑制--增强细胞 | Leu2[SB]+[/SB]8[SB]-[/SB] | |
| 抑制—增强细胞(激活) | Leu2[SB]+[/SB]8[SB]-[/SB]DR[SB]+[/SB] | |
| 抑制—效应细胞 | Leu2[SB]+[/SB]8[SB]+[/SB]15[SB]+[/SB] | |
| 组织相容限制的细胞毒性细胞 | ||
| 第一类限制性 | Leu2[SB]+[/SB]15[SB]-[/SB]DR[SB]-[/SB](7[SB]+[/SB]?) | |
| 第二类限制性 | Leu3[SB]+[/SB] | |
| 第二类反应性 | Leu2[SB]+[/SB] | |
| 非组织相容性限制的细胞毒细胞 | ||
| NK亚群 | Leu7[SB]+[/SB]11[SB]+[/SB]15[SB]+[/SB] | |
| Leu7[SB]-[/SB]11[SB]+[/SB]15[SB]+[/SB] | ||
| Leu7[SB]-[/SB]11[SB]+[/SB]DR[SB]+[/SB] | ||
| B细胞 | Leu12[SB]+[/SB]14[SB]+[/SB]16[SB]+[/SB]DR[SB]+[/SB] | |
| CR2[SB]+[/SB]k[SB]+[/SB]或λ[SB]+[/SB] | ||
| 亚群 | Leu12[SB]+[/SB]1[SB]+[/SB] | |
| Leu12[SB]+[/SB]1[SB]-[/SB] |
外周血白细胞的机能,特别是淋巴细胞的机能状态在一定程度上反应了机体的免疫机能。近几年来,用FCM来测定某些疾病的淋巴细胞及其亚群已成为重要的诊断和预后判断的指标,如对骨髓、器官移植,白血病、淋巴瘤的诊断和对免疫缺陷病的估价等。测定淋巴细胞亚群的主要依据是在于淋巴细胞表面不同的抗原表现型,而这些表现型又依赖于相应的单克隆抗体而被识别。所以,特异性很高的单克隆抗体结合先进的FCM,已为临床提供了不少非常有用而重要的资料,但被FCM所分析的淋巴细胞的整个临床意义尚未完全认识清楚。随着更多确定淋巴细胞表现型的试剂的应用,FCM对诊断和治疗计划的拟定以及预后的估计将会表现出更重要的实用意义。
1.T淋巴细胞亚群的测定如前所述,在使用FCM分析时,先用0[SB]。[/SB]散射和90[SB]。[/SB]光散射双指标将白细胞分为三群:淋巴细胞、单核细胞和粒细胞。在二维点图上划出淋巴细胞群范围后,设立GFL的RFL单指标的直方图。命电子计算机仅计数所输入的淋巴细胞,即划线框出的那部分细胞。一般计数输入的细胞可设1000~5000个。直方图的分析可显示阳性细胞的百分率。应用输入细胞数、阳性细胞百分数以及白细胞分类计数,就能得到阳性细胞的绝对值,即每立方毫米血液中的绝对值。有时T淋巴细胞某亚群的绝对值比百分率更为重要,因为它可以表明T细胞某亚群的增高和减少。当然,淋巴细胞占白细胞的百分数也是一个重要数据,应当准确测出。
CD[XB]4[/XB]/CD[XB]8[/XB]细胞的比值,有时也用于反映病人淋巴系统的机能状态。不少临床免疫实验室已把CD[XB]4[/XB]/CD[XB]8[/XB]的值作为常规血检查的项目。在国际上,淋巴细胞亚群以及CD[XB]4[/XB]/CD[XB]8[/XB]并未建立统一数值,各实验室均需建立自己的标准。平均值一般为1.73~2.00。
一般而言,影响淋巴细胞亚群的因素较多,如年龄、性别、种族、以及外周围环境如季节 、药品等的影响。T细胞的绝对值在儿童略高于成人。婴儿CD[XB]4[/XB]细胞的百分率较成年人高;老年人的CD[XB]8[/XB]略低。正常人在一昼夜内也有周期性的波动:上午CD[XB]4[/XB]略低,下午4时之后开始增加,直至次晨,平均波动为15%~20%。尽管正常情况下淋巴细胞亚群有所变动,但仍属正常范围。某些疾病,如器官移植、免疫疾病、免疫抑制和一些淋巴细胞肿瘤,其淋巴细胞亚群及其比值测量结果均可能偏离正常范围。
有工作报道,传统的T辅助诱导细胞(CD[XB]4[/XB][SB]+[/SB])具有抑制机能,而在T抑制细胞毒细胞(CD[XB]4[/XB][SB]+[/SB])中,有些又具有协助的功能。因此,对原来设想的CD[XB]4[/XB]、CD[XB]8[/XB]的机能分群有所混淆。预计会有新的单克隆抗体再从CD[XB]4[/XB]和CD[XB]8[/XB]的细胞中分出。不过就目前看来,不少临床免疫实验室已用CD[XB]4[/XB]/CD[XB]8[/XB]比值结合淋巴细胞绝对值对多种疾病的诊断、治疗和预后的估计提供了不少有价值的资料。
2.艾滋病以及HLTV—III感染艾滋病是一种由人类T淋巴细胞病毒(HLTV--III)感染而造成的疾病。这种病毒主要侵袭CD[XB]4[/XB][SB]+[/SB]T细胞,而导致CD[XB]4[/XB]淋巴细胞减少,CD[XB]4[/XB]/CD[XB]8[/XB]淋巴细胞比值下降,甚至可低到0.5以下。艾滋病多发生在同性恋性行为活跃的男性,这可能与多次重复感染HLTV-III有关。对异性性行为活跃的人来讲,对HLTV—IIi 感染的机会也不容忽视。另一种感染的途径是HLTV血清阳性的献血者对受血者的感染。有部分人血液中T淋巴细胞减少,CD[XB]4[/XB]/CD[XB]8[/XB]比值下降,但HTLV血清反应不一定就是阳性。有些人CD[XB]4[/XB]减少不明显,但CD[XB]8[/XB]有所增加,也会导致CD[XB]4[/XB]/CD[XB]8[/XB]的的比值下降。
对可疑为艾滋病及血清检验为阳性的人,T细胞亚群是分析了解免疫系统被病毒破坏程度的标志。初诊时,CD[XB]4[/XB]细胞越少,CD[XB]4[/XB]/CD[XB]8[/XB]值越低者,预后越差。所以经治疗后恢复的指标则是CD[XB]4[/XB]细胞数增加,CD[XB]4[/XB]/CD[XB]8[/XB]比值升高。用荧光标记双染色的FCM分析的结果表明,艾滋病人除CD[XB]4[/XB]和CD[XB]8[/XB]的改变外,同时还可以表现出OKT[XB]10[/XB]阳性细胞增多(图10-15)。病人表现为CD[XB]8[/XB]和OKT[XB]10[/XB]同时增加时,预后比OKT[XB]10[/XB]阳性细胞低的病情严重。
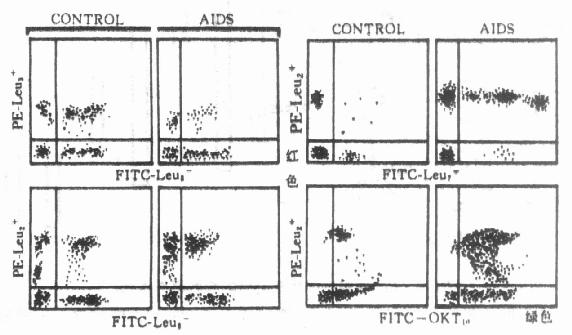
图10-15 健康人艾滋病人淋巴细胞表面抗原的比较
艾滋病人Leu[XB]3[/XB][SB]+[/SB]、Leu[XB]8[/XB][SB]-[/SB]和Leu[XB]3[/XB][SB]+[/SB]、Leu[XB]8[/XB][SB]+[/SB]细胞均减少,而Leu[XB]2[/XB][SB]+[/SB]、Leu[XB]8[/XB][SB]-[/SB]细胞相应增加,
Leu[XB]2[/XB][SB]+[/SB]、Leu[XB]7[/XB][SB]+[/SB]与Leu2[XB]3[/XB][SB]+[/SB]、Leu[XB]10[/XB][SB]+[/SB]细胞明显增加
3.白血病和淋巴瘤的表现型 近年来,为了弄清这些肿瘤的病理组织形态、影响治疗效果的原因与免疫状态的相互关系,对于不同类型的白血病和淋巴瘤作为广泛的细胞表面表现型的研究。
在诊断方面,FCM与单克隆抗体结合,可以弄清这些肿瘤的免疫起源,特别是分清B细胞性、T细胞性或骨髓性肿瘤。同时,还可以证实一些与细胞起源相关的抗原,如普通急性淋巴细胞性白血病抗原(CALLA、CD[XB]10[/XB])。另外,可以用适当的试剂从反应免疫过程中来证实单克隆的肿瘤细胞的增殖。
大部分淋巴系统肿瘤均起源于B细胞。而B细胞肿瘤常用抗免疫球蛋白的抗体来证实。由于前B细胞与浆细胞表面均无免疫蛋白,所以用检测免疫球蛋白的办法就只能证实B细胞发育中间时期的肿瘤。目前,已有一系列的B细胞表面抗原被发现,而可以证实B细胞个体发育的各个时期的肿瘤。
对B细胞肿瘤最有价值的抗原是CALLA。这种抗原仅存在于B细胞正常以育期的前B细胞、早期B细胞以及80%~90%的急性淋巴细胞性白血病。因此,抗CALLA抗体可以区别淋巴细胞性和髓性白血病。用抗CALLA结合其它一些成熟B细胞的单克隆抗体,如CD[XB]19[/XB],CD[XB]20[/XB],CD[XB]24[/XB](B[XB]4[/XB],B[XB]1[/XB],BA[XB]-1[/XB])将能证实大部分B细胞来源的肿瘤。图10-16给出了B细胞分化的各个时期细胞膜的表现型。来源于B细胞的肿瘤和正常B细胞的表现型相似,也就是说,B细胞前身、成熟B细胞及最后分化为分泌B细胞—浆细胞。
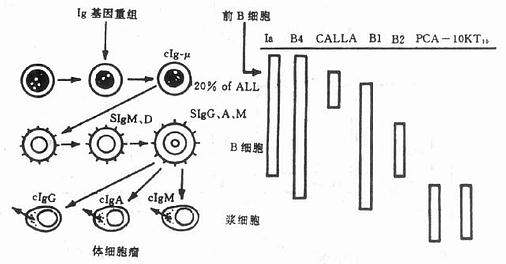
图10-16 B细胞分化各时期的细胞膜表现型
由于T淋巴细胞来源的肿瘤浸润性较强,预后较差,并需要多种治疗。T细胞肿瘤的表现型千变万化,但大部分均表现T细胞抗原CD[XB]7[/XB](Leu[XB]9[/XB],3A)或其它T细胞抗原CD[XB]2[/XB]、CD[XB]5[/XB](OKT[XB]11[/XB],OKT[XB]1[/XB])。这些抗原与肿瘤的细胞成熟时间有关,因而有助于拟定治疗方案。从FCM分析的结果表明,非成熟的T细胞肿瘤常表现非成熟的T细胞抗原,如CD[XB]1[/XB]和t[XB]10[/XB]。而成熟的T 细胞肿瘤则仅表现成熟T细胞抗原:CD[XB]2[/XB]、CD[XB]3[/XB]、CD[XB]5[/XB]和CD[XB]7[/XB]。有时也可表现CD[XB]2[/XB]、CD[XB]8[/XB],但不会出现在同一个细胞上面。
由于肿瘤细胞的多种来源,很难避免在肿瘤标本中混杂正常细胞,这给FCM的分析带来技术上的困难。如残留的红细胞在FCM分析时,落入淋巴细胞框定的范围内而造成淋巴细胞各种亚群百分率下降。所以在制备标本时,应尽量想法去除红细胞。另一种污染是正常细胞存在于肿瘤细胞之间,这是一个很头痛的问题。例如骨髓常被外周血污染,反应性的正常淋巴细胞渗入到肿瘤组织中等,因此估计污染程度对解释FCM分析的资料有一定的意义。因为在FCM分析时,正常细胞与肿瘤细胞可能由于不同的体积和密度而被分开,根据对污染的估计,仔细分析图像就能得到比较正确的结果。
4.FCM对正常B细胞和B细胞肿瘤分析FCM对正常B细胞和B细胞肿瘤的分析在免疫学研究和临床诊断上有着重要的实用价值,B细胞的某些特征必须使用FCM来分析,但是这在FCM技术方法中仍存在着一些需要解决的问题。
(1)B细胞的标记:B细胞膜表现免疫球蛋白(SIg)存在于所有成熟B细胞。最早的B细胞前身,细胞质内含有免疫球蛋白M(IgM),但不存在于细胞膜表面。细胞质内IgM的证实以及同时测定细胞表面的SIg,对FCM是很困难的,当然今后可能会用双染法来解决这样的难题。大部分成熟B细胞具有SIgM和SIgD,少量具有SIgG和SIgA,当然这也可能是因为不同的亚群的缘故。但仅以Ig的重链来分类B细胞是不可靠的,因为B细胞可以从膜表面的IgM逐渐转变成IgG,因而从重链着手无法把B细胞分类。大部分B细胞肿瘤也表现出带有SIgM和SigD。随着B细胞逐渐转变成浆细胞,膜表面Ig 逐渐丧失,在细胞质内又出现大量的免疫球蛋白。
与重链相反,B细胞的整个发生期只有一种k或者λ轻链,B细胞肿瘤克隆仅表现一种轻链,因此通过在FCM上显示的不平衡的轻链表现可以确定B细胞肿瘤。测定方法见(3)。
用SIg的最大缺点是它的“嗜细胞性”,因为正常B细胞、自然杀伤细胞(NK)、激活T细胞以及所有巨噬细胞均有Fc段受体,因而可以不同程度地与抗SIg单克隆抗体的Fc段结合而产生非特异性的结果,因此选择抗体时,应使用已被胃蛋白酶消化过的、Fc段也被去除的、仅留下来的F(ab’)[XB]2[/XB]。
(2)FCM测定B细胞的临床指证:
①免疫缺陷;免疫缺陷可以是先天性或获得性的。低丙种球蛋白白血症和无丙种球蛋白白血症常伴有免疫球蛋白分泌的紊乱,因此有必要分析B细胞。
②淋巴瘤:非何杰金氏病的淋巴病,80%来源于B细胞。因而一旦怀疑为淋巴瘤,就应仔细用FCM对B细胞的表现型进行分析,可以分析血、骨髓、以及活检淋巴结等。首先确定肿瘤细胞的来源:B细胞性(CD[XB]20[/XB][SB]+[/SB],SIg[SB]+[/SB])或T细胞性(CD[XB]3[/XB][SB]+[/SB])。也有可能某些淋巴病来源于单核细胞(CD[XB]11[/XB][SB]+[/SB])成裸细胞而表现出非T非B。一旦确立为B细胞来源后,就应更进一步分析克隆增殖的性质:单克隆、少克隆、或是多克降珠。单克隆性的增殖往往是肿瘤的标志。可以用SIg的轻链和重链分别加以测试,往往轻链比重链更有价值。在不久的将来,或许可以直接用免疫球蛋白的基本加以鉴别。
对B细胞亚群的确定,目前并未定论,但某些B细胞被CD[XB]5[/XB](T[XB]1[/XB],OKT[XB]1[/XB])染色。正常B细胞中这些细胞较少,而多见于慢性淋巴性白血病和骨髓移植后的免疫缺陷时期。在B细胞的肿瘤病人中,10%的也可以出现CD[XB]20[/XB](B[XB]1[/XB])阴性反应,这是B细胞成熟而将分化为浆细胞的标志。在异常B细胞上,往往有一些B细胞的标记缺失或其它表现型出现,因而对异常B细胞的FCM的分析尤为重要。图10-17显示CD[XB]19[/XB]—FITc (B细胞)和CD[XB]5[/XB]-PE(T细胞)双染色的假三维图像分析。X轴为绿色荧光的Leu[XB]12[/XB](B细胞),Y轴为红色荧光的PE—Leu[XB]1[/XB](T细胞)。从图中可见,有较多的细胞表现出Leu[XB]12[/XB][SB]+[/SB]tLeu[XB]1[/XB][SB]+[/SB],阴性区内为NK细胞和红细胞等。
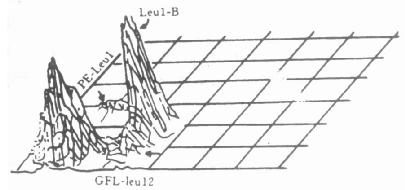
图10-17 异常B细胞双染色的假三维图
(3)k-λ测定B细胞克隆:k、λ测定法是一种从正常B细胞中测定少量B细胞克隆生长的方法。其基本原理是:若有B细胞克隆存在,将改变某一种轻链(k或λ)的荧光强度的分布。若轻链为k的B细胞生长,则抗k的抗体能测试出这种变化,而抗λ的抗体的测试没有任何改变。正常情况下,B细胞的k和λ的荧光强度分布是一致的(见图10-18)。
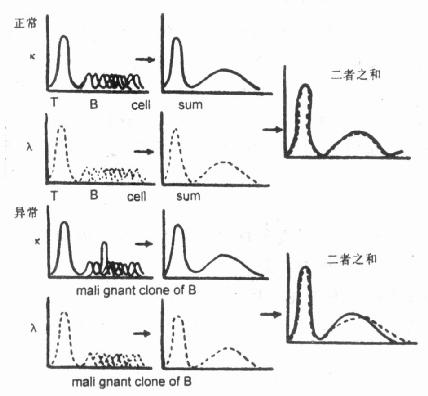
图10-18 k-λ克隆的测定
正常情况,B细胞轻链分布图像,一致κ和λ的波形没有区别。但在异常时,若有单克隆生长,κ链有分布则与λ不一致,在总和的曲线形态上也会产生差异。
在实际应用中,血液、体液、组织细胞的悬浮液效果均较好,而对于骨髓,大量细胞的非特异性标记会影响测定的结果。这里面必须强调,正常B细胞中的克隆细胞生长并不意味着它们必然是肿瘤细胞,还必须结合其它指标再做结论。不过这种方法对确定肿瘤细胞的存在、细胞发育阶段、以及经治疗后病情控制的状况等,都可以提供一些有用的资料。
以上仅限于从外周血的白细胞分析这一侧面介绍了FCM的某些疾病中的临床应用。其实,它也仅只是问题的一个部分。例如,有研究工作表明:CD[XB]34[/XB]抗原在由红系、巨核系、粒系和巨噬细胞三个细胞成株单元组成的成株细胞中有所表现。CD[XB]34[/XB][SB]+[/SB]细胞在人的骨髓细胞中约占1~4%,而在外周血中却探测不到。又如,NK细胞近来被认为可能和人类的某些疾病的发病机理有关,对NK细胞的测量可以作为免疫治疗的免疫监测的重要参数和有效的预后征状的指示。以前是用放射性的[SB]51[/SB]Cr的释放来检测NK敏感的靶细胞的毒理学活性从而评估NK的功能的,而采用荧光探针CFDA(car-boxy—fluorescein diacetate)标记则可用FCM技术更为安全可靠地进行测定。有报告指出,健康男人的数值为(67.1±22.7%)%,健康女人为(63.9±20.0%);患有妇科癌肿病人则为(38.5±23.1)%,明显偏低。这些工作表明,FCM的技术从免疫组织化学角度还会有所发展。在第二节 我们曾简单介绍了流式细胞分析技术在生物医学工程中应用的一些技术途径,这也可以启发我们借助于FCM来提高免疫组织化学的分析能力。可以预见,FCM一定会成为免疫组织化学的一项重要的技术工具,并将在医学科研和临床应用中发挥更大的作用。
附【美国Becton –Dickinson 公司可提供的FCM标准】荧光微球(Fluorescent beads);鸡红细胞核(Chicken erythrocyte nu-clei)和小牛胸腺细胞核(Calf thymocyte nuclei),用于DNA测量的质量控制;单克隆抗体试剂;以及用于免疫表型(immunopheno-typing)和其它临床应用的药盒。
