第一节 无菌动物
一、无菌动物的基本概念
所谓无菌动物,就是指不能检出任何活的微生物和寄生虫的动物。从微生物学的观点看,通常实验动物的体内和体外带有寄生虫,体内还常带有细菌和病毒,而且还都难于排除某些潜在的传染病。此外,普通实验动物的血清中含有抗体。所以用并存普通动物进行医学科学研究,将会存在各种各样的干扰,实验结果往往不确切。使用无菌动物作实验就可以克服普通实验所存在缺点,使实验结果正确可靠。
无菌动物是在无菌屏障系统中,剖腹取出胎儿,饲养繁育在无菌隔离器中,饲料、饮水经过消毒,定期检验,证明动物体内外均无一切微生物和寄生虫(包括大部分病毒)的动物。无菌动物的“菌”主要是指细菌,而严格来说,还包括真菌、立克次氏体、支原体和病毒等微生物及各种寄生虫。而所谓“无”却不是绝对的,不过是根据现有的科学知识和检查方法在一定时期内不能检出已知的微生物和寄生虫而已。随着科学技术的发展,现在认为是无菌的动物或许将来可以检出微生物和寄生虫而不是无菌动物,因为这个“无”是相对而言的。到目前为至,尚未确立无菌动物的微生物检定法,因此,研究者的检定方法各式各样,其中病毒和立克氏体的检查尚有相当多的问题。例如,在无菌动物中供实验室使用最多的无菌小鼠,用电子显微镜检查证明,胸腺细胞中仍有存在白血病病毒的例子,因而,现在的所谓无菌动物,指动物体内外未能检出细菌、真菌、原虫、内外寄生虫的动物较妥当。
用大量抗菌素也可以使普通动物暂时无菌,但是这种动物不是无菌动物。因为这种无菌状态往往是一过性的,某些残存的细菌在适当的条件下又会在体内增殖;即使能把体内细菌全部杀死,它们给动物造成的影响却是无法消除的,例如:特异性抗体的存在、网状内皮肤系统的活化、某些组织或器官的病理变化等。因此,无菌动物必须是生来就无菌的动物。
按对微生物的控制的程度,可以将实验动物分为四类:即(1)无菌动物(Germ Free,GF);(2)悉生动物或已知菌动物(Gnotobiotics,GN);(3)无特定病原体动物(Specific Pathogen Free,SPF);(4)通常动物(Conventional,CV)。无菌动物和悉生动物饲养于隔离器中(隔离系统),无特殊病原体动物饲养于屏障系统,通常动物饲养于开放系统。
通常动物是在开放系统条件下饲养的,都受到自然界微生物和寄生虫的侵袭,一般都带细菌、病毒和寄生虫。有的动物外观看起来健康,其实都隐藏着某些疾病或有微生物与寄生虫的感染。因此用通常动物进行实验敏感性差、反应性不一致,实验结果缺乏再现性。要提高动物实验的准确性,就必须对实验动物在遗传和微生物两个方面加以控制,培养出标准的合格动物,才能使实验结果正确可靠,达到反应均一性和重复性。采用兄妹间近亲交配殖繁20代以上所培育的近交系动物,遗传均一、个体差异小、实验结果比较准确。但是只从遗传上加以控制,如不进行微生物控制,没有排除自然感染的微生物和寄生虫的影响,实验结果仍可能不准确。因此,在精度要求高的实验中,无菌动物、悉生动物和无特殊病原体动物就成了理想的实验动物。
表6-1 按微生物控制程度的实验动物分类原则
| 种 类 | 饲养方法 | 说明 | 附 记 |
| 无菌动物 | 隔离系统 | 以封闭的无菌技术取得,用现有方法不能检出任何微生物和寄生虫的动物。 | |
| 悉生动物 | 隔离系统 | 确知所带的微生物丛(植物的和动物的)经特殊饲养的动物。 | 确知所带有的微生物 |
| SPF动物 | 屏障系统 | 没有指定的致病性微生物和寄生虫的动物。 | 确知不带有的微生物 |
| 通常动物 | 开放系统 | 不明确所带的微生物、寄生虫的动物,赤称普通动物,但不得带有人畜共患的传染病病原体。 | 对微生物带有情况不明确 |
二、无菌动物的发展
无菌动物的产生和发展,已有近百年的历史,许多学者曾对肖椎动物和脊椎动物的无菌状态进行过反复的研究。无菌动物的研究,起源于19世纪后期,1885-1886年间,确立了在动物体内没有微生物也能生存的概念。1885年,Dudeaux曾将豌豆在无菌条件下进行栽培,证明无菌植物不能利用供给的养分。同年Pasteur认为,动物在没有肠道细菌参与条件下不能生存。1886年Neucki提出相反的看法,认为细菌对于动物的生存不是必需的。因此展开了一场争论。约10年后,1895年Kijanizin在无菌代谢试验笼内饲养兔,给予无菌空气、饲料和水,兔的体重逐渐下降,并因负氮平衡而死亡。同年Nuttall和Thierfelder经剖腹产获得豚鼠,饲养于玻璃罩内,每小时人工哺以灭菌牛奶和纯动物性饲料一次,共计8天,动物外观健康,将此动物于第8天处死,其肠内容物没有检出细菌。1914年Cohendy也曾饲养过无菌豚鼠,但是没有获得成功。14年后Glimstedt继续开展无菌豚鼠的研究,于1932年,终于把无菌豚鼠养活两个月,取得了初步进展,至1959年Teah在Notre Dame大学已能使无菌豚鼠繁殖。
关于无菌鸡的培育,早在1897年Schottelius就曾获得,但没有继续养活。1908年Cohendy育成无菌鸡,且生长情况良好。1935年Kimura,Naito和Kobayashi在日本京都大学饲养了无菌鸡。1944年Luckey和Lakey又开始进行无菌鸡饲料营养的研究。1948年美国Lobund小组饲养的无菌鸡,成长后第一次产卵,并孵化出新的一代,从此饲养无菌鸡获得完全的成功。
由于1922年Baeot和Harden发现无菌蝇蛆必须饲喂B族维生素才能正常生长,证明了无菌动物对B族维生素的需要,因为无菌动物肠内没有细菌存在,自身不能合成B族维生素,从而找到了过去的饲养无菌动物失败的原因。1937年Balzam在无菌鸡的维生素B族缺乏症及在鸡体内能否合成B族维生素的研究中,更加清楚地证明了这个问题。无菌动物对B族维生素需要的发现是很有价值的,它推动了无菌动物培养工作的发展,并使之走向成功。
第一个无菌大白鼠群是美国Lobund小组于1951年建立的。第二个无菌大白鼠群是Gustafsson于1956年在瑞典建成。1959年Reyniers在Tempa大学建立无菌动物实验室。印度的无菌动物群于1959年在印度大学医学中心建立。
随着无菌动物研究的开展,无菌动物的饲养装置也不断地改进。1915年德国的科斯特首次创造无菌动物培育隔离器。1928年美国圣母大学细菌学实验室的Reyniers创造了不锈钢制的无菌动物大型隔离器。从此开展了无菌动物的系统实验。现在美国有48个无菌动物研究单位,仅国立卫生研究院的5个研究所里,就分别设有无菌动物研究室。1930年Gustafsson设计了第二型隔离器,整个隔离器的原料是不锈钢的。在日本,自1946年开始培育无菌动物,1959年宫川用不锈钢做隔离器的主体部分,并附有小的玻璃观察窗和灵敏的机械手,使不锈钢隔离器达到比较完善的地步。但这种隔离器既笨重造价又昂贵,不可能大量推广使用,因而也限制了无菌动物工作的开展。在日本现有24个单位从事无菌动物研究工作,仅在东京就有9个无菌动物研究单位。50年代,发明了用过氧乙酸进行表面灭菌的方法以后,1957年P.C.Trexler在美国印第安那州圣母大学Lobund研究室里创造了塑料膜隔离器,用无毒聚氯乙烯薄膜制造隔离器的主体部分。由于这类隔离器制作方便,既轻便又实用,所需用费用又不高,仅为不锈钢隔离器的几十分之一,灭菌方法也大为简便,因此日渐广泛地得到应用,促进了无菌动物研究的发展。
1978年Lobund研究室的Morris Pollard博士来华讲学时给我国赠送了一具Trexler隔离器,中国医科院动物中心已仿制成功,上海、苏州等地也已制作成功,并已小批量生产。近二年来,Trexler教授亲自来华讲学,传授隔离器和无菌动物饲养繁殖技术,促进了我国无菌动物研究的发展。现在北京、上海等地已有几个单位在研究无菌动物。
此外,澳大利亚、比利时、西德、苏联、捷克、英国、法国、意大利等国和地区,都已建立了包括无菌动物在内的实验动物中心。
对无菌动物的研究最初只是为了探讨高等动物与体内微生物之间的关系。19世纪末,Nattal氏及Thierfelder氏用剖腹术取出了妊娠豚鼠的胎儿,在无菌环境下饲养了10天。随后,Schettelus发现鸡的胚胎是无菌的,后来成功地进行了雏鸡的无菌化。无菌动物所具有的独特优越性使其成为一种新型的实验动物。随着生物学的进步和技术的发展,试行了各种动物的无菌化,现在无菌动物的品种已经很多,不仅小鼠、大鼠、豚鼠和家兔等小动物已有无菌动物,而且狗、猫、猴、猪、山羊、绵羊和牛等大动物以及鸡、火鸡、鹌鹑、青蛙、蛇甚至蚕、苍蝇、白蚁等也都有了无菌动物。这些都是为了适应科学发展的需要而培育的,其中的小鼠、大鼠、豚鼠,国外一些发达国家已能大量生产,并比较方便地应用于日常研究中了。已育成的无菌动物见表6-2。
表6-2 已育成的无菌动物
| 种 类 | 培育者及育成时间 |
| 小 鼠 | Pleasants,1959 |
| 大 鼠 | Reyniers等,1946:Gustafsson,1948;Pleasants,1959 |
| 豚 鼠 | Miyakawa等,1958;Tanami,1959;Pnillips等,1959;Horton和Hickey,1961;Newton和Dewitt,1961 |
| 兔 | Wostmann和Pleasants,1959;Luckey,1963 |
| 狗 | Glimsedt,1946 |
| 猫 | Bleby,1969 |
| 山羊、绵羊 | Smith,1961,1966 |
| 猪 | Whitenair,等,1960 |
| 马 驹 | Drummond等,1973 |
| 猴 | Reyniers,1942 |
| 鸡 | Reyniers,1943 |
| 鹌 鹑 | Woodard等,1965;Miles,1966 |
三、无菌动物的特征
只要饲料配备适当,无菌动物发育正常,外观和普通动物相同,但是其机能、结构和普通动物有很大的不同。无菌动物受两个因素影响,即微生物和因饲养比较聚集而致的肾上腺增大。
无菌动物的特征主要反映在下面二个方面
(一)形态学改变
1.消化系统:主要变化在肠道
⑴无菌动物肠道肌层薄,更为特异的是盲肠肥大,比普通动物要大5-6倍。无菌豚鼠的盲肠可达体重的1/3。主要是由于肠壁薄、张力低而增大。由于盲肠膨大,肠壁菲薄,常因盲肠扭转或肠壁破裂而死亡。如给无菌动物注入梭状芽孢杆菌则可缩小盲肠体积。
⑵肠粘膜绒毛增多。
⑶肝脏重量下降。
2.循环系统:心脏相对缩小。
3.血液系统:白细胞增加。普通动物白细胞总数波动范围大,无菌动物白细胞数值恒定。
4.网状内皮系统:脾脏缩小,无三级滤泡,网状内皮细胞功能降低。
(二)生理学改变
1.免疫功能:由于网状内皮系统、淋巴组织发育不良,淋巴小结内缺乏生发中心,产生丙种球蛋白的能力很弱(在检查无菌动物的无菌性时,血清丙种球蛋白阴性可以作为无菌的一个辅助证据),又因为体内无微生物和寄生虫,血中无抗体,血清杀菌力低,吞噬细胞噬菌力也低,因此对微生物感染异常敏感,某些病原性弱和必须经腹腔或颅脑接种才能感染普通动物的微生物很容易感染无菌动物。
2.生长率:无菌条件下对不同种属影响不同。无菌鸟类生长率高于同种的普通鸟类;无菌大小鼠与普通鼠差不多;无菌豚鼠和无菌兔生长率比普通者慢。因肠内无菌,不能帮助消化纤维素以提供机体所需要的营养。
3.生殖:无菌条件对动物的生殖影响不大。大鼠和小鼠因出生无感染身体较好;无菌豚鼠及兔比普通者繁殖力低,可能因大盲肠之故。
4.代谢:血中含氮量少,肠管对水的吸收率低,代谢周期比普通动物长。
5.营养:与动物品种有关,豚鼠和兔的肠道长,故有影响。无菌动物肠道上皮细胞更新率比一般动物低,肠壁的物质交换也较慢。无菌条件下的各种动物通过胆汁排泄代谢产物的速率均减慢;如切除无菌动物的盲肠,则无菌动物与普通动物的差异缩小。无菌豚鼠和无菌兔在切除盲肠后,其生殖率增加。关于盲肠增大的原因,曾进行过许多研究,尚无明确结果。推测可能是因为饲料中的有毒物质刺激盲肠,使其增大加长、弹性减少。正常情况下饲料中的毒性物质可被肠道菌分解。无菌条件对兔及豚鼠的盲肠产生的影响最大,Sabourdy曾称量过无菌豚鼠的盲肠(连同肠内容物),结果盲肠相当于豚鼠体重的1/3。
6.寿命:无菌大鼠和小鼠比普通者长寿。
四、无菌动物技术
无菌动物在自然界并不存,必须用人为的方法养育而成。一般将临产前的健康动物用麻醉药品或拉断颈椎处死后,立即浸泡在37℃灭菌液中,送进无菌室(或无菌隔离器),按无菌手术进行剖腹,切除带胎子宫(子宫内首先应无菌),将其浸入消毒液里并立即输送到另一只隔离器中,切开子宫取胎,经用灭菌纱布揩拭仔体并断脐(电刀切断)后,放入隔离器内人工喂乳或用其他品系的无菌雌鼠作保姆代养。象小鼠和大鼠等用人工喂乳非常麻烦,故采用保姆代养。而象豚鼠因在一定程度上能自力饮乳,故人工哺乳较容易。另外,象禽类、鱼类、昆虫类等,因是在卵中无菌的前提下作出的,故用药物将卵周围灭菌后移入灭菌隔离器内使其孵化即可,而且,这些动物,一般在出生后就能自力采食,故较易育成。
无菌动物的理论基础和实践依据在于胎盘屏障和屏障观念,根据这个基础开展了无菌动物工作。在无菌条件下取仔,一切操作在无菌隔离器内进行。
(一)哺乳类无菌动物技术
小动物作子宫切除术(Hysterectomy);大动物做子宫切开术(Hysterotomy)获得幼仔。子宫切开对兔子可用三次,但易污染,不如子宫切除术取仔安全。大动物主要从经济角度考虑,采用子宫切开取仔术。取仔程序如下:
1.腹部剃毛或用硫化钠脱毛剂脱毛。
脱毛剂配制:
硫化钡 50克
湿润剂 4克
甘油10克
水50毫升
作成类糊状用以脱毛。
2.处死妊娠雌鼠。一般不用化学药品处死,以兔影响胎鼠。如用化学药品时,应使剂量对胎体无影响时方可使用。一般对小鼠用断颈髓处死。较大的动物如豚鼠用氟烷(Halothane Oxygen)吸入麻醉,不用乙醚麻醉。
3.处死的雌鼠浸泡于37℃灭菌液中2分钟。灭菌液配制:
福尔马林20%
季铵5%
苄烷氨水75%
4.将妊娠鼠固定住,并于腹部粘上灭菌胶布。
5.剖腹。
6.取出子宫:
⑴将子宫放入灭菌液中,之后将盛子宫的小筐递到另一隔离器中取胎鼠。这样,在隔离器中有充分的时间检查其是否污染。
⑵如将子宫直接在无特定病原体条件下取胎和饲养则有危险,可能受染而无机会观察。
7.用剪刀剪开子宫壁,取出胎鼠,轻按以帮助呼吸,不立即断脐,待呼吸正常时再用电刀切断脐带。
8.分开胎盘,将取出的幼仔放到代乳母鼠身边,把代乳母鼠的幼仔取出与剖腹产取出的幼鼠接触,使之有同样的气味,便于代养。
9.剖腹取胎的时限。
⑴小鼠、大小:9-10分钟;
⑵豚鼠:5分钟,因豚鼠耐缺氧能力低弱。
乳汁制备:首先用挤奶机获得兔奶,冷冻干燥,经γ射线消毒,保存于塑料袋中,贮放在隔离器内。需用时将奶粉加水恢复干燥前的浓度,不加维生素和其他成份。须注意人工喂养经常出现因灌喂入肺而致死。家兔3次/日,后来发现1次/日即可。根据家兔年龄及体重考虑每两日加量1次。第1天喂5毫升,可维持1次/日;以后逐渐增加到4-5次/日;第3周时即可吃饲料。
自1958年以来,小鼠不用人工喂养。Sabourdy开始培育无菌小鼠时,每天喂5次,有时半夜去喂小鼠,实际上无此必要。自广泛使用隔离器后,都靠代乳鼠喂养。Sabourdy还认为中国如开始培育无菌动物工作,不必采用人工喂养,因现在各国有许多实验动物中心有无菌动物,运输也方便,可以从他的或别的实验室引进代乳鼠。
代乳鼠的最适期:在隔离器中交配,约于部腹服胎前1-2天产仔。C3H和C57BL品系为常用的代乳鼠。用作手术取胎的母鼠最好不是第一胎的。一般用做交配的雄鼠下午时放入,第二天上午8时将雄鼠取出。做剖腹产需了解雌鼠的妊娠期。特种鼠的妊娠期取足月的。小鼠性周期为4天多,如用100只雌鼠交配,应有25只雌鼠受孕,实际上若用10%已属不错。如果10只雌鼠受乳,用Whitten氏反应法,100只雌鼠可有30%受孕。
(二)鸟类无菌动物技术
常用鹌鹑,也用鸡。研究营养用无菌鸡,要选育无白血病的鸡群。饲养无菌鸡比较容易。雏鸡出壳即可啄食,不用人工喂饲。关键在于消毒卵壳,因卵壳不平,不易灭菌。首先选外壳干净的受精卵。按以下程序进行:
1.将受精卵放至湿润剂中。
2.再放入2%升汞中浸12分钟。
3.将浸泡过的受精卵放入隔离器中孵育。
建立无白血病鸡群无从母鸡选起,用这种鸡卵培育无菌鸡。否则仅外壳消毒是消灭不了鸡白血病病毒。
五、无菌动物的饲料和饲育装置
(一)无菌动物的饲料
无菌动物的饲料水必须符合下列要求:
1.没有活的微生物和寄生虫或虫卵,因此,必须经过充分的灭菌,一般多用高压灭菌。有条件可用60钴照射灭菌,效果好,而且营养成份破坏少,保存时间长。根据我们研究证明采用1.5-2.5Mrd60钴γ线照射的饲料灭菌效果显着,能保持无菌状态达4个月以上;营养成份破坏较高压灭菌法显着少,如维生素B243.7%、E17.5%、C8.5%、蛋白质11%、胱氨酸17.5%、赖氨酸14等;饲喂LACA小鼠和裸鼠后效果良好。值得推广应用。
2.必须补充因高压灭菌而破坏的营养成份,如:维生素B1、维生素C、泛酸等。补充的营养成份用滤菌器过滤后加入饲料或饮水中饲喂。为了减少营养成份的破坏,最好用放射线灭菌或环氧乙烷灭菌法代替高压灭菌法。
3.无菌动物没有肠道正常菌丛,饲料中还须补充这些细菌合成的营养成份。
4.饲料的组成、形态和气味等应尽可能适合动物的习性和嗜好。
(二)无菌动物的饲育装置
无菌动物必须在与自然界微生物完全隔绝的无菌隔离器内饲育。旧式的无菌隔离器是用不锈钢等金属材料制成的,内部用高压蒸气消毒,由于成本高、操作不方便,现在已被塑料无菌隔离器所取代。塑料隔离器是用硬透明塑料制成的,内部用过氧乙酸等消毒液喷雾消毒,由于成本低、便于观察、操作方便,目前已被广泛采用。我国生产的塑料隔离器最近在中国医学科学院实验动物中心已通过鉴定,并已成批生产。
无菌隔离器必须具备下面五个条件:
1.必须是一个对微生物密闭的容器,其内部空间和内容物能接受高压蒸气或化学药品灭菌处理。
2.隔离器的空间以及内容可随时被观察。
3.隔离器内部应随时在视野下从外部进行工作,但不破坏内部的无菌环境。
4.必须装置一个有内外门的无菌通道,动物或食物以及其它物品可以从外部无菌地输送到隔离器内部去,而不被坏内部的无菌环境,送出时亦然。
5.必须装置一个无菌进行出气系统,内部保持适度的高气压。
塑料无菌隔离器的结构模式见图6-1。
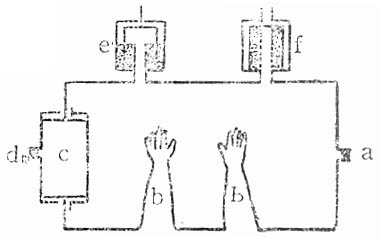
图6-1 塑料无菌隔离器
其形态大小因应用的目的和动物的品种、数量而异,一般大小为1.80米×0.65米×0.5米,但是结构原理基本相同。大体上分为收容间、缓冲间和空气交换装置三部分。收容间有一个消毒药液的喷雾孔(a)和一付密封在塑料板上的橡胶手套(b),内部各种操作都要通过手套进行。手套是活动的,可以更换,为延长手套使用期限,手套外面加布手套。缓冲间(c)有两个开口和一个喷雾消毒药液的孔(d),动物、饲料、饮水和各种用具都通过缓冲间出入,两个开口要交互打开,以防空气污染收容间。空气交换装置由空气过滤器(e)和排气阀(f)两部分构成,排气阀能阻止空气逆流,以防污染。内部的气压应比外部略高,以利于换气。
六、无菌动物的检查
为了确认无菌动物的无菌状态,及时发现污染,必须定其进行检查。检查材料以粪便为主,也可检查饲料、饮水和铺垫物等,或用消毒棉花擦拭隔离器内面或对动物饮食器皿表面进行培养。培养基可用牛肉浸液、硫乙醇酸盐培养基、血液琼脂、马铃薯琼脂或沙保弱氏琼脂等,分别在20℃、37℃、55℃作好气和厌气性培养。同时还要进行呼吸道支原体的检查和各种寄生虫检查,对于病毒,不可能一一进行分离培养,一般是通过临床观察、细胞培养或病理组织学检查作判定。
