第二节 发热的原因和机制
一、致热原和激活物的概念
传统上把能引起人体或动物发热的物质,通称为致热原(pyrogen)。根据来源又把致热原划分为外源性致热原和内生致热原,用以表示来自体外或体内。近年来不少学者认为,许多外源性致热原(传染原或致炎剌激物)可能主要是激活产内生致热原细胞,使后者产生和释放内生致热原,再通过某种途径引起发热。因此,外源性致热原用乃是体内产生内生致热原细胞的激活物(activators),或称为发热激活物。此概念并不排除一些外源性致热原与机体相作用,在体内引起激活物的产生,因而体内某些产物,也可成为产内生致热原细胞的激活物。当然也不排除有些激活物或其成分,如能通过血脑屏障,也可能以一定方式作用于体温调节中枢,而发挥双重作用(即既可促使内生致热原的产生,又可作用于中枢),或还可能通过内生致热原以外的中介物从外周进入脑内,参与发热的机制。
在第一种内生致热原(白细胞致热原)被发现后,最近几年又相继发现三种新的内生致热原,这些新发现的内生致热原还来不及系统深入的研究,而白细胞致热原则已积累大量系统研究资料。关于发热激活物的系列资料,都是围绕白细胞致热原所进行的实验研究所取得的。
二、发热激活物的主要种类和性质
有许多物质(包括外源性致热原和体内某些产物)能够激活产内生致热原细胞而使其产生和释放白细胞致热原。下面介绍的仅是几种常见或重要的激活物。
(一)微生物
革兰氏阴性细菌的菌壁含有内毒素(endotoxin,ET),后者是一种有代表性的细菌致热原(bacterial pyrogen)。给家兔微量静脉内或更微量脑内(视前区-前下丘脑)注射,均可引起明显发热。ET的活性成分是脂多糖,它有三个组成部分,即O-特异侧链、核心多糖和脂质A(lipid A)。脂质A是决定致热性的主要成分。
临床上输液或输血过程中所产生的发热反应,多数就是由于污染ET所致,因其耐热性很高,需干热160℃2小时才能灭活,一般灭菌方法不能清除。目前多数学者认为,ET性发热是由于ET激活了产内生致热原细胞,使其释放白细胞致热原所致体外实验证明。用微量ET与白细胞培育,可使后者产生释放白细胞致热原;给家兔或狗静脉内注射ET,在引起发热的同时,血清中出现大量循环白细胞致热原。最近的一些研究证明,ET还能激活单核细胞产生其它内生致热原。此外,ET在外周还可能引起其它代学介质的生成,后者经血脑屏障进入脑内而参与中枢机制。但出不能完全排除ET本身或其降解产物进入脑内发挥致热作用的可能性。ET的分子量很大,达1,000-2,000KD,一般剂量静脉内注射,显然难以通过血脑屏障并进入脑内。但是,大剂量注射ET,有无可能削弱血脑屏障而致小量ET通过,或者由于某些生理过程(包括传染、毒血症或高热)提高了脑毛细血管的通透性,导致ET或其降解产物得以自由通过,这个可能性还不能完全排除。有的学者报道,单独注射ET不能通过血脑屏障,但联合使用A型链球菌致热性外毒素时,ET就能够通过血脑屏障。
革兰氏阳性细菌(如肺炎球菌、白色葡萄球菌、溶血性链球菌等)感染也能引起发热。给家兔静脉内注射活的或加热杀死的葡萄球菌,均能引起发热,因而其效应不取决于传染是否成立,而可能是细菌颗粒本身起的作用。加热杀死的葡萄球菌在体外与白细胞培育,能激活产内生致热原细胞,使其产生释放白细胞致热原。在剂量—效应关系上,取决于细菌颗粒数与细胞数的比例。
从革兰氏阳性细菌体内能分离出有致热性的外毒素,例如从葡萄球菌分离出的肠毒素,和从A型溶血性链球菌分离出的红疹毒素(erythrogenic toxin),都是强激活物,微量给动物静脉内注射即可引起发热。体外实验证明,红疹毒素与家兔白细胞培养,能使后者产生释放白细胞致热原。
病毒感染,例如把流感病毒、麻疹病毒或者Coxsackie病毒注入家兔静脉内,都可引起动物发热。在发热的同时,血清中出现循环白细胞致热原。实验证明,病毒也可能过激活产内生致热原细胞产生释放白细胞致热原引起发热,其激活作用可能与血细胞凝集素(hemagglutinin)有关。在体外用副流感病毒与家兔血白细胞培育,能激活后者释放白细胞致热原。
此外,螺旋体(回归热的病原体疏螺旋体属Borrelia,钩端螺旋体等)及真菌引入体内也可引起发热。在体外把赫姆斯氏包柔氏螺旋体(Borrelia hermsii)或酵母分别与人体白细胞培育,都能激活后者产生释放白细胞致热原。
(二)致炎物和炎症灶激活物
有些致炎物如硅酸结晶,尿酸结晶等,在体内不但可引起炎症反应,其本身还具有激活产内生致热原细胞的作用,并已证明,尿酸结晶或硅酸结晶的激活作用,不取决于细胞对它们的吞噬,因为用细胞松弛素B或秋水仙素制止吞噬,不影响白细胞致热原的产生和释放。
除某些非传染性致炎物以及传染原有激活作用之外,非传染性炎性渗出液中还含有激活物。实验证明,给家兔腹腔灌注生理盐水后,把从腹腔收集到的渗出白细胞置于生理盐水中培育。能释放白细胞致热原;但把正常血白细胞置于生理盐水中培育,则无白细胞致热原释放。若先加入从腹腔收集到的无细胞渗出液到正常血白细胞中培育,然后再置于生理盐水中培育,则血白细胞也能释放白细胞致热原,表明在渗出液中含有激活物。
(三)抗原-抗体复合物。
抗原-抗体复合物对产内生致热原细胞也有激活作用,举下述实验为证;
皮内注射青霉素-佐剂乳状物或静脉内注射水溶性青霉素或肌肉内注射普鲁卡因青霉素,使家兔致敏,然后给这种致敏兔静脉内注入青霉素-血清蛋白结合物,可引起动物发热;在有致敏兔的含抗体血清的参与下,把致敏兔的血细胞与上述结合物作体外培育,能释放白细胞致热原,表明抗原-抗体复合物起了激活作用。用牛血清蛋白使家兔致敏。然后把致敏动物的血浆或血清转移给正常家兔,再用特异抗原攻击受血动物,可以引起后者发热。但牛血清蛋白对正常家兔却无致热作用,表明是由于抗原-抗体复合物起了激活作用。已证明,用人体血清蛋白给家兔致敏后,再用人体血清蛋白攻击,约5分钟后就可在循环血中出现抗原-抗体复合物。
(四)淋巴因子
淋巴细胞不产生和释放内生致热原,但抗原或外凝集素能剌激淋巴细胞产生淋巴因子(lymphokine)后者对产内生致热原细胞有激活作用。实验证明,用卡介苗(bacille Calmette-Guerin,BCG)给家兔致敏,然后用旧结核菌素攻击可引起发热。这种反应可通过致敏的脾和淋巴结细胞被动转移给正常家兔。把致敏或未致敏的家兔血白细胞在体外与特异抗原培育时,不能释放白细胞致热原,如果同时加入致敏的淋巴细胞一起培育,则能使白细胞释放白细胞致热原。这是因为致敏淋巴细胞-抗原混合物所形成的一种可溶性产物起激活作用,这种产物就是淋巴因子,它可能主要来自T淋巴细胞。
(五)类固醇
体内某些类固醇(steroid)产物对人体有明显的致热性,睾丸酮的中间代谢产物本胆烷醇酮(etiocholanolone)是其典型代表。石胆酸也有类似作用。但实验证明,本胆烷醇酮的种系特异性很强,给狗、猫、大鼠、小鼠、豚鼠、家兔和猴作肌肉内注射,均不引起发热,只有当给人体肌肉内注射时,才引起明显发热。体外实验证明,人体血白细胞与本胆烷醇酮培育,经几小时激活能产生释放白细胞致热原。
已证明,本胆烷醇酮的致热性取决于类固醇的5-β-H构型,因为5-α-本胆烷醇酮不具致热性。同样,它在体外对白细胞的激活作用,也取决于5-β-H构型。
某些周期性发热病人,常找不到发热的原因,而血浆中的本胆烷醇酮的浓度有所增高。另一种类固醇,如糖皮质激素和雌激素,则能抑制白细胞致热原的产生释放。因此有人用类固醇代谢失调来解释某些周期性发热。例如一些肝硬变的发热病人,伴有血浆中本胆烷醇酮浓度升高,被怀疑是类固醇代谢失调所致,但仍有争议。
三、内生致热原
(一)白细胞致热原
1.细胞来源 1984年Beeson等首先发现家兔腹腔无菌性渗出白细胞培育于无菌生理盐液中,能产生释放致热原,并称之为白细胞致热原(leucocytic pyrogen,LP)。为表示其来自体内,又称之为内生致热原(endogenous pyrogen,EP)。现在已经证明,白细胞中的单核细胞是产生LP的主要细胞。此外,组织巨噬细胞,包括肝星状细胞、肺泡巨噬细胞、腹腔巨噬细胞和脾巨噬细胞等,以及某些肿瘤细胞,均可产生并释放LP。
近年来对LP的系统研究中,发现它除引起发热外,还引起许多疾病急性期反应,表明其生物活性与白细胞介素-1(interleukin-1,IL-1)一致,现已公认LP就是IL-1。由于从不同侧面研究IL-1或LP,对它的细胞来源有了更多了解。根据目前所知,能产生IL-1(LP)的细胞种类,可列表如下(表4-1)。
表4-1 LP(IL-1)的细胞来源
| 巨噬细胞 | 肿瘤细胞 | 其它细胞 |
| 血单核细胞 | 骨髓单核细胞性肿瘤细胞 | 表皮角化细胞 |
| 肺泡巨噬细胞 | 白血病细胞 | 郎罕氏细胞 |
| 肝星状细胞 | 何杰金氏淋巴肉瘤细胞 | 角膜上皮细胞 |
| 脾巨噬细胞 | 牙龈渗出细胞 | |
| 腹腔巨噬细胞 | 肾细胞癌细胞 | 神经胶质细胞 |
| 滑膜巨噬细胞 | 肾小球膜细胞 | |
| 骨髓巨噬细胞 |
2.产生和释放 产LP细胞如何产生和释放LP,根据对人体白细胞体外培育实验的观察,这一过程包括三个阶段,即激活、产生和释放。
激活过程可能从激活物的有效成分与产LP细胞膜的特异受体结合开始,然后发生吞噬(以及消化细菌)。此时细胞产生一系列的代谢反应,包括耗氧量增多、糖酵解增强,以及各种水解酶的释放等。曾有人认为激活过程就是吞噬过程,但进一步的研究表明,事实不尽如此,当吞噬被事先制止时,某些激活物颗粒仍然能发挥激活作用。
一般在激活后(指体外培育)1~2小时,可能是LP生成的初期。在此期,事先加入到培养基中的同位素标记氨基酸能掺入到新生成的LP中;若加入蛋白质和核糖核酸的合成抑制物,则可抑制LP的生成,表明此期需要有新合成的核糖核酸(mRNA)和蛋白质来保证。已证明LP合成是需能过程。给氟化钠能阻止合成。
过了此期,即在激活2小时之后,似乎不再需要蛋白质的新合成了。因为在此之后加入蛋白质合成抑制物,已不再影响LP的生成和释放了。
血白细胞合成的LP,在3~16小时内释放。在此期LP可能由非活化型经酶的作用,转化为活化型。不像合成是需能的,释放LP是不需能的过程;阻断细胞呼吸不干扰LP的释出只有细胞死亡或破裂才中止释放。因此LP可能是通过细胞膜而释出的。
3.化学性质据目前所知,LP大致是一种较小分子的蛋白质,共耐热性低,加热70℃20分钟即可破坏其致热活性。蛋白酶如胃蛋白酶、胰蛋白酶或链霉蛋白酶,都能破坏其致热性。
LP在体内的动力学尚欠系统研究,但已知它主要由肾脏清除。
LP的分子量各家报道不一,多数认为人或兔的LP约13~15KD;也有人报道,人体提纯的LP有15KD和38KD两种,后者同样不耐热,也可为胰蛋白酶所破坏。后来的资料表明,较大分子的LP可能是分子量为15KD的LP的三聚体。据报道,人体和小鼠肿瘤细胞也可释出不同分子量的LP,可能是二聚体或三聚体。
LP的等电点有两型,即p17和p15这两型都有相同的致热性和其它生物活性。
4.抗原性和致热性交叉反应LP表现高度的抗原特异性。在兔体内对人体LP产生的抗体,只能破坏人体LP的致热性,而对家兔、豚鼠和猴的LP的致热性不能破坏。根据这种抗原特异性,有的实验室已建立对人体LP的放射免疫检测方法。
虽然LP有高度抗原特异性,但其致热性则在某些种系动物中可呈交叉反应。例如人体LP可引起家兔或小鼠发热;家兔LP能引起蜥蜴发热,大鼠LP可引起家兔发热。这种交叉致热性表明,上述不同种系动物产生的LP,必然有共同的有效部分,能为其靶细胞的特异受体所接受。
5.生物学效应 LP有明显的致热性。从家兔渗出白细胞制备的LP,其粗提物的致热性约为300~400μg蛋白质引起家兔(约2.5~3.0kg体重)平均发热1℃;经滤膜过滤和层析滤过而获得的较纯的LP,致热性约为0.1~0.2μg引起家兔发热1℃。表明LP的致热性很强。
除发热效应之外,LP还能引起疾病急性期的多种反应,包括中性粒细胞增多、低铁血症、低锌血症、高铜血症、肝脏急性期蛋白合成增多。后者包括纤维蛋白原、结合珠蛋白、血浆铜蓝蛋白、C-反应蛋白、α1-抗胰蛋白酶、血清淀粉样物质A及某些补体成分等。与此同时还出现肌肉蛋白水解增多和氨基酸血症,以保证急性期蛋白合成增多的需要。因此,LP是疾病急性期反应的一种中介分子或系列中介分子之一。
(二)新发现的内生致热原
除LP外,近年来又发现三种内生致热原。
1.干扰素干扰素(interferon,IFN)是细胞对病毒感染的反应产物,这种糖蛋白物质去糖后仍具活性。由人类白细胞诱生的hIFN,已应用于临床,有抗病毒,抑制细胞尤其肿瘤细胞生长的作用。1984年Dinarello等证明,给家兔静脉内注射hIFN。能引起单相热,其致热性不是由于污染ET。对ET产生耐受性的小鼠,注射hIFN仍引起发热且不减弱;其致热性也不是由于LP的作用。在家兔hIFN性发热期间,循环血未出现LP;体外培育单核细胞加入适量hIFN不引起LP的释放。给猫脑室内(intracerebroventricular,ICV)注射hIFN照例引起发热,表明它本身具有致热性。
2.肿瘤坏死因子肿瘤坏死因子(tumor necrosis factor,TNF)也是巨噬细胞分泌的一种蛋白质,ET能诱生之。重组TNF(rTNF)已用于临床1期治疗肿瘤,有非特异杀伤肿瘤细胞的作用,给人注射能引起发热反应。Dinarello等(1986)用家兔实验验证其致热性:静脉内注射1μg/kg迅速引起单相热,10μg/kg引起双相热,在第二热相血浆中出现循环LP。体外实验证明。rTNF能激活单核细胞产生LP。TNF在70℃中加热30分钟,失去致热性50%。加热的10μg/kg只引起单相热。但LP加热70℃30分钟,则失去全部致热性。TNF不同于ET,每天注射不出现耐受性。Dinarello等认为TNF双相热的第一热峰是TNF直接作用于体温调节中枢所致,第二热相是通过LP而引起的。
3.巨噬细胞炎症蛋白-1 最近Wolpe等(1988)新发现一种单核细胞因子,是一种肝素-结合蛋白质,对人体多形核白细胞有化学促活作用(chemokinesis),在体外能引起中性粒细胞产生H2O2,皮下注射此因子能引起炎症反应,故称之为巨噬细胞炎症蛋白-1(macrophageinflammatory protein-1,MIP-1)。进一步研究(Davatelis等,1989)发现,MIP-1给家兔静脉内注射引起剂量依赖性发热反应,热型呈单相。其致热性既不是由于污染ET,也不是由于含有LP或TNF,也不依赖于PGE,表明它是另一种具有致热性的EP。
四、致热原的作用部位
哺乳类动物和人类的体温相对恒定,是依赖体温调节中枢调控产热和散热的平衡来维持的。视前区-前下脑(preopticanterior hypothalamus,POAH)是体温调节中枢的高级部分,次级部分是延脑、桥脑、中脑和脊髓等。当POAH进行正常活动时,次级中枢退居次要或备用地位。而当POAH失去活动(如被病灶或人工破坏)时,次级中枢可能取代之而发挥积极作用。无论对体温调节或致热原的反应,可能都是如此。
至于致热原(包括ET或LP)的作用部位,迄今尚难确定。许多实验证明,在脑内存在着对ET或LP起反应的敏感区。用直接微量注射的方法显示,这种敏感区正好集中于下丘脑体温调节中枢,其它中枢部位的敏感性较低或不敏感。因此,只要有小量ET或LP通过血脑屏障进入脑内,就有可能作用于敏感区而引起发热效应。目前还未有证据可以表明,ET或LP能作用于外周温度感受器或其它外周调温结构而引起发热。
由于ET的分子量很大,LP的分子量较小,因此多数学者认为,循环ET不能通过血脑屏障而作用于POAH,LP则能通过血脑屏障而作用于POAH。其实至今对此仍不能最后肯定或否定。关于ET能否通过血脑屏障,前文已有论述。关于LP,近年来有的学者提出其作用部位可能位于血脑屏障外的脑血管区。这个特殊部位,称为下丘脑终板血管器(organum vasculosum laminae terminalis,OVLT)位于第三脑室壁的视上隐窝处(图4-2)。这里的毛细血管属于有孔毛细血管,LP可能通过这种毛细血管而作用于血管外周间隙中的巨噬细胞,由后者释放介质再作用于OVLT区神通元(与POAH相联系)或弥散通过室管膜血脑屏障的紧密连接,而作用于POAH的神经元。这种主张也有待进一步验证。
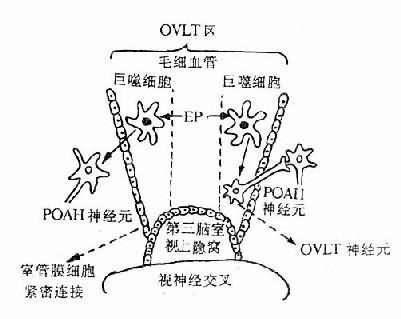
图4-2 OVLT在发热病学中的作用示意图(引自Stitt,1986)
近年来新发现的三种内生致热原的作用部位尚待确定。
五、内生致热原的作用方式
无论EP是否通过血脑屏障,它在给动物静脉内注射后,总要经过一段潜伏期才引起发热。因而它很可能要通过某种或多个中间环节,导致调定点上移,再通过调温反应而引起发热。

许多学者推测有某种或某些中枢介质(也称中枢发热介质)参与发热的中枢机制。先后被研究的有单胺(去甲肾上腺素、5-羟色胺)、前列腺素E(PGE)、花生四烯酸的其它衍生物,cAMP和Na+/Ca2+比值等。而最受重视的是PGE、cAMP和Na+/Ca2+比值。
(一)前列腺素
主张PGE是EP引起发热的主要介质的现行假说的最重要依据是:①脑内(下丘脑)或ICV注射PGE引起发热;②LP静脉内注射或IFn ICV注射引起发热是时,CSF中PGE2明显增多;③下脑组织分别与LP、IFN或TNF在体外培育时,都使PGE2合成增多;④阻断PGE合成的药物,对LP、IFN或TNF性发热都能解热。
鉴于目前仍无直接证据以示LP能从外周进入脑内,因而有的学者修改了此假说,提出PGE的释放部位是在OVLT区孔性毛细血管外周的巨噬细胞(参阅图4-2)。LP激活后者释出PGE,作用于OVLT区的神经元或弥散过室管膜细胞紧密连接而作用于POAH的神经元。
此外,Dinarello等(1986)认为TNF引起的双相热的第一相,是TNF引起下丘脑PGE增多的效应。
但是许多资料不支持PGE作为发热介质,其根据是:(1)PGE的两种特异拮抗物SC19220和HR546能抑止PGE性发热,但不能抑制LP性发热;(2)小剂量阿司匹林在抑制LP引起的CSF PGE增多的同时,可不抑制体温上升;(3)家兔两侧POAH摘除或损伤后,向该处或ICV注入PGE均不引起发热,但ICV注入LP仍能引起发热,表明不需PGE参与;(4)LP注入家兔POAH,使大部分热敏神经元敏感性受抑制,大部分冷敏神经元的敏感性提高,但PGE注入POAH,大部分热敏神经元不受影响,约1/2冷敏神经元也不受影响;(5)MIP-1的致热性与PGE无关。
因此,目前还难肯定PGE是EP性发热的主要介质。
(二)cAMP
脑内有较高cAMP,也有丰富的cAMP合成降解酶系。它又是脑内多种介质的信使和突触传递的重要介质,故当PGE作为发热介质有争议的同时,cAMP能否作为发热介质参与中枢机制,倍受重视。十多年前国外学者积累了一些资料,支持cAMP参与发热中枢机制,主要是:①把二丁酰cAMP给猫、兔、大鼠脑内注射,迅速引起发热;②家兔静脉内注射LP引起发热时,CSF中cAMP浓度明显增高,而环境高温引起的体温升高,不伴有CSF中cAMP增多。③注射茶碱(磷酸二酯酶抑制物)在增高脑内cAMP浓度的同时,增强LP性发热;而注射尼克酸(磷酸二酯酶激活物)则在降低cAMP浓度的同时,使LP性发热减弱。
至于LP如何引起脑内cAMP增多,最新研究资料表明,LP可能通过提高Na+/Ca2+比值,再引起脑内cAMP增多。
(三)Na+/Ca2+比值
实验表明,用生理盐水替换人工脑脊液作动物脑室灌注时,引起了猫的体温明显上升,而加入CaCl2则可防止体温上升。用等渗蔗糖溶液灌注后下丘脑,体温无变化;若加入Na+,就引起体温上升;若加入Ca2+,则可降温。因而提出体温调定点受Na+/Ca2+比值所调控,强调Ca2+浓度是调定点的生理学基础,Na+/Ca2+比值上升可致调定点上移,并确定其敏感区位于后下丘脑。
进一步实验证明,静脉内注射LP引起发热时,增加灌注脑室的人工脑脊液中的Ca2+浓度,可抑制发热效应。若把灌注液改为等渗蔗糖溶液,则静脉内注射LP不引起发热,表明LP可能通过提高下丘脑Na+/Ca2+比值,使调定点上移而启动调温反应,引起体温上升。在应用放射性同位素钠和钙的实验中发现,发热时下丘脑组织内Na+/Ca2+比值上升。
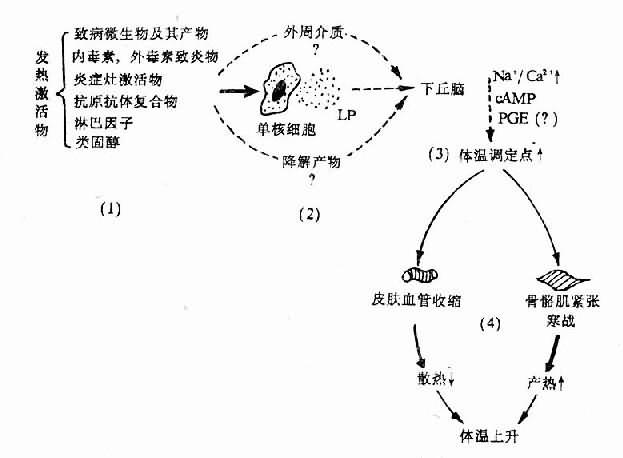
图4-3 发热发病学基本环节示意图
(未包括新发现的EP)
lP如何引起Na+/Ca2+比值上升,Na+/Ca2+比值上升又如何引起调定点上移,尚缺乏深入研究。但最近国内学孝者的研究证明,用降钙剂(EGTA)灌注侧脑室引起发热时,CSF的cAMP明显增多;若事先灌注CaCl2,可使EGTA性体温升高被制止,而且CSF中cAMP的增多也明显受抑制,体温变化与cAMP浓度变化呈明显正相关。继而又发现事先给家兔侧脑室灌注CaCl2,不但抑制静脉内注射LP引起的体温上升,而且抑制了LP引起的CSF中cAMP的增多,体温变化也与cAMP浓度变化呈明显正相关。因此提出:《LP→下丘脑Na+/Ca2+↑→cAMP↑》可能是多种致热原引起发热的重要共同途径。
总之,发热的发生机制比较复杂,有不少细节仍未查明,但主要的或基本的环节已比较清楚。概括起来,多数发热发病学的第一环节是激活物的作用,但至今其作用方式所知不多;第二环节,即共同的中介环节主要是EP。后者有多种,它们可能以不同给合或先后作用于POAH,或作用于外周靶细胞,再通过发热介质参与作用;第三环节是中枢机制,无论EP是否直接进入脑内,很可能要在下丘脑通过中枢介质才引起体温调定点上移,也不排除激活物的降解产物或外周介质到达下丘脑参与作用;第四环节是调定点上移后引起调温效应器的反应。此时由于中心温度低于体温调定点的新水平,从体温调节中枢发出调温指令抵达产热器官和散热器官,一方面通过运动神经引起骨骼肌的紧张度增高或寒战,使产热增多;另一方面经交感神经系统引起皮肤血管收缩,使散热减少;由于产热大于散热,体温乃相应上升直至与调定点新高度相适应。这些基本环节可用下列模式图加以表示(图4-3)。
